Lucas Resende Lucinda Mangia
Departamento de Otorrinolaringologia e Oftalmologia da Universidade Federal do Paraná (UFPR)
A migrânea é uma entidade clínica extremamente prevalente nas populações. Tem ganhado destaque crescente na Otoneurologia em decorrência dos avanços no entendimento de sua relação com o sistema vestibular. Seu reconhecimento é importante fator no surgimento de sintomas vestibulares recorrentes e sua presença marcante nos consultórios e ambulatórios da área – um provável reflexo do estilo de vida contemporâneo no mundo ocidental. A literatura médica em relação à migrânea ganhou exponencial robustez nas últimas décadas. Com ela, surgiram novas abordagens farmacológicas que têm modificado os planos terapêuticos ofertados aos pacientes, tanto durante a crise quanto como estratégias profiláticas. Sublinha-se que, apesar de promissoras para outros quadros relacionados à migrânea – como a migrânea vestibular, os ensaios clínicos que as validaram foram realizados no contexto centralizado na dor de cabeça para a seleção, inclusão e investigação dos resultados terapêuticos. Assim, sua extrapolação para outras situações é baseada no compartilhamento de fenômenos fisiopatológicos – sem lastro experimental suficiente até o momento.
Os desenvolvimentos mais significativos dos últimos anos no tratamento da migrânea exploram apresentações diversas da doença. Destarte, há alguns anos a toxina onabotulínica tem sido utilizada sobretudo para o tratamento preventivo de enxaqueca crônica em adultos no Brasil. Trata-se de uma neurotoxina derivada da bactéria Clostridium botulinum cujo efeito mais conhecido é a inibição da liberação de acetilcolina nas terminações nervosas periféricas, impedindo a contração muscular local. Sua indicação em quadros migranosos é baseada nos resultados satisfatórios de dois ensaios clínicos randomizados (PREEMPT 1 e 2). Acredita-se que, nesse caso, ela atue inibindo a liberação de neuropeptídeos associados com o surgimento da dor, como o CGRP, neurocinina A e a substância P, coibindo e revertendo processos de sensibilização central existentes na migrânea crônica. A eficácia, segurança e tolerabilidade da toxina onabotulínica A foram demonstradas em estudos posteriores e seus efeitos adversos são raros, transitórios e leves. São uma alternativa a ser considerada em casos refratários e/ou crônicos, porém ainda não são conhecidos quais fatores predizem melhor resultado de sua utilização. Estudos preliminares indicam possível benefício em casos refratários de migrânea vestibular. Efeitos esses, na conectividade de áreas de integração multissensorial em análises por ressonância magnética funcional.
Outras linhas de desenvolvimento em ampla expansão envolvem, de modo mais direto, o papel de neurotransmissores – mais especificamente a serotonina, e de moléculas biologicamente ativas, sobretudo o peptídeo relacionado ao gene da calcitonina (CGRP, da sigla em inglês). Vários estudos implicaram a serotonina na patogênese da migrânea. A maior parte dos neurônios presentes no núcleo dorsal do rafe (local de emergência do nervo trigêmeo), nos gânglios trigeminais e também nas terminações nervosas do V par, é serotoninérgica. Dos sete tipos de receptores da serotonina, os subtipos 5-HT1, 5-HT2 e 5-HT3 são aqueles mais implicados na cadeia de eventos relacionados à crise de migrânea. Sugere-se que os diferentes subtipos de receptores 5-HT possuem efeitos distintos na doença. Alguns poderiam estar envolvidos no desencadeamento dos episódios sintomáticos (por exemplo, 5-HT1C), enquanto outros podem preveni-los (por exemplo, 5-HT1D). Alguns autores advogam que o efeito vasoconstritor da serotonina também poderia repercutir na cadeia fisiopatológica da migrânea.
Há séculos atrás, as parteiras já utilizavam esporão-de-centeio para mitigar sangramentos uterinos pós-parto e, em 1918, a ergotamina foi isolada pela primeira vez por Arthur Stoll. Protótipo dos alcaloides do ergot, a ergotamina e seus derivados passaram a ser muito utilizados, em especial na Medicina Obstétrica. Na década de 1940, estudos sobre o centeio levaram à descoberta da serotonina, uma molécula com notável efeito vasotônico. Desde então, foi iniciada uma jornada em busca de uma substância que imitasse os efeitos dos alcaloides do ergot sem seus efeitos adversos. Na última década do século passado, o início da comercialização dos triptanos (p. ex, sumatriptano, naratriptano) trouxe a expectativa de um tratamento eficaz e mais seguro para as crises de migrânea. Os triptanos são agonistas da serotonina e se ligam fortemente a três subtipos de receptores: 5-HT1B, 5-HT1D e 5-HT1F. A atuação sobre 5-HT1D inibe a liberação de neuropeptídeos pelos aferentes trigeminais perivasculares. Por outro lado, sua alta afinidade sobre o receptor 5-HT1B, densamente encontrado no músculo liso dos vasos sanguíneos cerebrais, parece ser a principal responsável pelo efeito vasoconstritor desse grupo de substâncias. Contudo, é também esse mesmo efeito vasotônico que as tornam contraindicadas para populações de risco cardiovascular e/ou cerebrovascular. De modo geral, são consideradas medicações eficazes, porém de segunda linha para as crises agudas de migrânea de moderada a alta intensidade. Seu uso deve ser ponderado aos eventuais efeitos adversos vasculares.
Mais recentemente, foi desenvolvida uma nova classe farmacológica para o tratamento agudo da migrânea, os ditans, cujo principal princípio estudado é o lasmiditan. São compostos agonistas serotoninérgicos seletivos para 5-HT1F, subtipo de receptor extensamente distribuído pelo sistema nervoso central, porém com limitado efeito vasoconstritor e com esparsa presença nas coronárias. Sua ativação hiperpolariza as terminações nervosas trigeminais, levando à contenção do evento considerado central na fisiopatologia da migrânea: a ativação trigeminovascular. Pelo efeito restrito sobre 5-HT1B, parecem promissores como alternativas mais direcionadas e seguras aos triptanos.
O CGRP é um peptídeo de 37 aminoácidos descoberto em 1982. Sua relação com a migrânea foi progressivamente desvendada, de modo que se tornou alvo potencial de novas terapêuticas para a doença. O peptídeo se mostrou importante na patogênese da migrânea por seu papel na modulação da transmissão nociceptiva no sistema trigeminovascular. Acredita-se que esse neuropeptídeo atue nas terminações trigeminais amplificando o processo inflamatório local, além de apresentar efeitos vasodilatadores que também podem incorrer em crises da doença. Ressalta-se que, tal qual a serotonina, o CGRP também é expresso no sistema vestibular e pode estar igualmente implicado na gênese da migrânea vestibular.
Os primeiros bloqueadores do receptor do CGRP, chamados gepants, demonstraram excelentes resultados no controle da crise, porém com riscos de lesão hepática. Avanços posteriores culminaram na aprovação de fármacos da classe para uso preventivo, o atogepant, e para o abortamento dos episódios sintomáticos, o rimegepant e o ubrogepant. O rimegepant, entretanto, tem se mostrado promissor também em seu uso profilático. Com isso, tais medicações podem futuramente tornar as fronteiras entre tratamentos de crise e profiláticos mais imprecisas. Atualmente, considera-se o uso abortivo dos gepants uma opção em pacientes com resposta insuficiente ou contraindicação aos triptanos.
Anticorpos monoclonais (mABs) injetáveis contra o receptor ou a molécula de CGRP também foram desenvolvidos e se mostraram capazes de prevenir a vasodilatação neurogênica no sistema nervoso central, sem alterar parâmetros fisiológicos cardiovasculares. É interessante notar que seus efeitos ocorrem apesar do fato de não atravessarem a barreira hematoencefálica. O erenumabe é o principal integrante dos mAbs direcionados ao receptor do CGRP. É usado mensalmente como injeção subcutânea e apresenta risco potencial de hipertensão arterial sistêmica. Foi descontinuado no Brasil por razões comerciais. O fremanezumabe e o galcanezumabe são mAbs direcionados ao CGRP de uso subcutâneo. Enquanto o fremanezumabe pode ser usado a cada três meses, o galcanezumabe deve ser usado mensalmente. O eptinezumabe é um mAbs também direcionado ao CGRP, mas de uso intravenoso trimestral. Foi demonstrada sua eficácia tanto em profilaxia quanto como medicação abortiva, porém não se encontra disponível em nosso país. Embora apresentem efeito moderado de resposta e ainda haja uma fração considerável de pacientes refratários, os mAbs se revelaram uma opção interessante para pacientes sem resposta com outras classes de medicação profilática. Teoricamente, ainda devem ser evitados naqueles com eventos isquêmicos recentes devido aos efeitos cardioprotetores e vasodilatadores do CGRP. Em comparação às outras classes, no entanto, aparentam ter baixa taxa de eventos adversos, baixo risco e comodidade posológica que pode facilitar a adesão terapêutica. Seu uso combinado a outras terapias foi pouco explorado até o momento. A FIGURA 1 ilustra esquematicamente os alvos moleculares de novas terapêuticas para migrânea que exploram a participação do CGRP e da serotonina em sua fisiopatologia.
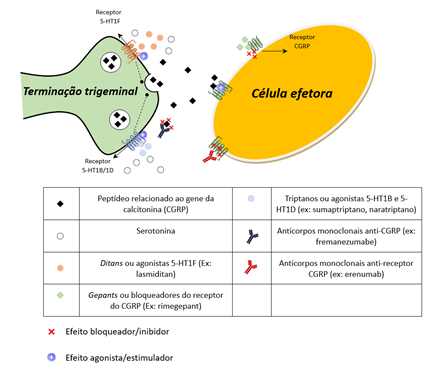
Figura 1: Alvos celulares e moleculares dos fármacos para migrânea que atuam nas vias fisiopatológicas envolvendo a serotonina e o CGRP.
Linhas de pesquisa ainda mais incipientes têm evoluído com a promessa de trazer novas alternativas farmacológicas ao controle da migrânea. Entre elas, pode-se citar o bloqueio da via do PACAP-38 (peptídeo ativador da adenilato ciclase pituitária). Trata-se de um neuropeptídeo que, à semelhança do CGRP, é liberado em crises migranosas e cujo receptor, denominado PAC1, é largamente encontrado no sistema trigeminovascular. Acredita-se que o PACAP-38 é capaz de modular a nocicepção em diferentes níveis do sistema nervoso central. O antagonismo do PAC1, por sua vez, reduz a sensibilidade à dor e parece ser um bom alvo terapêutico na migrânea. Nesse sentido, mAbs direcionados ao PAC1 têm sido desenvolvidos e novos estudos podem reforçar futuramente o arsenal terapêutico da migrânea.
Independentemente do olhar esperançoso para o futuro e as novas medidas farmacológicas em desenvolvimento, é essencial que o paciente com migrânea continue a ser avaliado e abordado de maneira abrangente, empática e personalizada. Como seu processo fisiopatológico é complexo e dinâmico, dificilmente haverá um fármaco único e milagroso para todos os pacientes. Dessa maneira, na mesma medida em que os médicos devem estar atentos às novidades, evidências científicas prévias merecem ser revisitadas. As possibilidades terapêuticas não-farmacológicas precisam ser sempre ponderadas e, idealmente, o manejo integral do indivíduo acometido deve continuar a embasar qualquer plano de tratamento proposto.
Referências
Lucas Resende L Mangia
Departamento de Otorrinolaringologia e Oftalmologia da Universidade Federal do Paraná (UFPR)
Com os avanços da Medicina nas últimas décadas, uma mudança significativa no perfil epidemiológico das doenças foi observada. Em relação às causas de mortalidade, por exemplo, houve uma transição marcante para doenças cardiovasculares e neoplásicas. O olhar da comunidade médica e científica voltou-se para o manejo de condições crônicas, como a obesidade, o diabetes mellitus e a hipertensão arterial sistêmica. Essas condições, por sua vez, caracterizam-se por fisiopatologia mais complexa, largamente multifatorial e intrinsecamente relacionada ao estilo de vida. Da necessidade de debelar moléstias infecciosas, tornou-se então fundamental o cuidado longitudinal em saúde, visando ao controle dessas doenças crônicas.
Nesse mesmo sentido, as modificações do perfil e estilo de vida das populações, em especial ocidentais, trouxe profundas alterações nas morbidades intercorrentes durante a vida dos indivíduos. Também aqui tornaram-se proporcionalmente menos frequentes as doenças infecciosas, com aumento da prevalência de condições crônicas de ordem alérgica, inflamatória, funcional e degenerativa, por exemplo. Tais moléstias, por sua vez, se destacam pelo evidente impacto em qualidade de vida e funcionalidade do paciente acometido. Não por menos, se tornaram as campeãs dos atendimentos em ambulatórios das mais diversas especialidades.
Similarmente, tem-se observado um notável crescimento na manifestação e agravamento de casos de migrânea e seus equivalentes. Aqui, vale reforçar o conceito de migrânea como uma entidade clínica com espectro amplo de manifestações, de fisiopatologia bastante complexa e que pode, ao longo da vida, apresentar-se de maneiras bem distintas. Ou seja, não deve ser compreendida como um distúrbio restrito às cefaleias – manifestações mais conhecidas, mas incluir gama de sintomas variados que refletem um transtorno da modulação sensorial e sensibilização central. Na Otorrinolaringologia – sobretudo na Otoneurologia, a fração de casos de vestibulopatia recorrente causados pela migrânea (migrânea vestibular) ou de alguma forma impactados por migrânea coexistente (por exemplo, doença de Ménière com migrânea, migrânea como complicador de deiscência de canal semicircular superior) elevou-se consideravelmente. É inegável supor que seja um reflexo do estilo de vida contemporâneo, marcado pelos pronunciados prejuízo do sono e dos momentos de lazer, pelo consumo desmedido de alimentos processados, pela redução da mobilidade diária mínima, pelo uso desenfreado de equipamentos eletrônicos, pela agitação e excesso de estímulos da vida urbana e pelas elevadas cobranças sociais e profissionais contemporâneas.
É fundamental que o médico Otorrinolaringologista e Otoneurologista esteja atualizado quanto ao manejo da migrânea. E os últimos anos trouxeram uma série de novidades nesse sentido. Aqui, salienta-se que tais avanços tem origem em estudos de pacientes com dor de cabeça migranosa, de modo que sua transposição para outros acometimentos relacionados à migrânea ainda são embasados pelo compartilhamento natural de princípios fisiopatológicos – e não por investigações científicas direcionadas. Com o maior reconhecimento do espectro da migrânea, contudo, espera-se que os próximos anos possibilitem recomendações mais específicas para casos, por exemplo, de migrânea vestibular.
Aqui, cumpre sublinhar os princípios da abordagem do paciente migranoso (Tabela 1). Primeiramente, esse indivíduo precisa ser reconhecido e diagnosticado. Por apresentar manifestações muito diversas e ser muito comum, a migrânea faz diagnóstico diferencial e é condição concorrente em variados cenários clínicos. Apenas o atendimento médico pormenorizado permite que o quadro seja suspeitado e levado em consideração. Aqui, a atualização contínua dos profissionais que lidam com esse tipo de caso é indispensável. Uma vez diagnosticada, é salutar orientar o paciente sobre o quadro e colocá-lo no centro do seu cuidado. Isso significa explicar bases e mecanismos das alterações encontradas, identificar conjuntamente potenciais fatores impactantes, controlar expectativas, retirar dúvidas e situar o paciente como principal responsável pela sua melhora clínica.
|
Fundamentos do manejo de pacientes com migrânea e seus equivalentes |
|
Suspeita, reconhecimento e diagnóstico corretos e oportunos |
|
Educação, orientação e aconselhamento do paciente sobre seu quadro |
|
Tratamento eficaz e tempestivo das crises sintomáticas |
|
Recomendações preventivas individualizadas e consideração de profilaxia medicamentosa, se necessário |
|
Reavaliação periódica da adesão terapêutica e dos resultados |
|
Avaliação e tratamento de complicações |
|
Identificação e manejo de comorbidades relacionadas |
|
Seguimento de longo prazo visando a manutenção da estabilidade clinica |
Tabela 1: Princípios do tratamento longitudinal da migrânea e seus equivalentes.
Por ser uma doença crônico-episódica, é vital que o paciente saiba lidar com as crises de migrânea. Essas agudizações podem apresentar-se de maneira variada de um paciente para outro e em um mesmo indivíduo. De qualquer maneira, trata-se de eventos que podem ocorrer – embora devam ser prevenidos com as medidas cabíveis. Saber lidar com esses episódios diminui a ansiedade, alivia desconfortos e contribui significativamente para reduzir o fardo da doença e a percepção geral do paciente sobre o problema. Nesse momento, o abortamento da crise envolve, em suma, controle dos sintomas existentes (Tabela 2). Queixas de dor devem ser abordadas com o uso de medicações que tragam resposta com a menor carga de efeitos adversos. Assim, o uso de analgésicos comuns, anti-inflamatórios como o naproxeno ou medicações de classes específicas, como os derivados do ergot (ex: diidroergotamina) ou os triptanos, podem ser utilizados. A resposta comumente é idiossincrática e é preciso que o paciente conheça o medicamento a que se adapta melhor, contrabalanceando resultados, riscos e efeitos colaterais. É fundamental que o uso seja parcimonioso e jamais preventivo, para evitar a cefaleia por abuso de analgésicos, um complicador do quadro.
|
Principais classes de medicações para tratamento das crises de migrânea |
|
|
Sintoma-alvo |
Classe medicamentosa |
|
Dor |
Analgésicos comuns |
|
Anti-inflamatórios não-esteroidais |
|
|
Alcaloides derivados do ergot |
|
|
Triptanos |
|
|
Anti-inflamatórios corticoesteroides |
|
|
Novos grupos: ditans, gepants |
|
|
Náuseas e vômitos |
Antagonistas da serotonina (5-HT3) |
|
Antagonistas dopaminérgicos de ação central |
|
|
Anti-histamínicos |
|
|
Anti-colinérgicos |
|
|
Tontura e vertigem |
Bloqueadores de canais de cálcio |
|
Anti-histamínicos |
|
|
Benzodiazepínicos |
|
Tabela 2: Principais classes medicamentosas utilizadas para tratamento dos sintomas na crise migranosa. Fonte: o Autor.
Tanto os derivados do ergot como os triptanos atuam sobre receptores serotoninérgicos e não devem ser usados em conjunto. Os triptanos, com ação agonista um pouco mais seletiva sobre os receptores 5-HT1B e 5-HT1D, costumam ser mais toleráveis. Contudo, ressalta-se que ambas as classes de medicações apresentam efeito vasoconstritor. Por isso, são contraindicadas na hipertensão arterial não controlada, na doença cardíaca isquêmica, na doença cerebrovascular e nas insuficiências vasculares periféricas arteriais ou venosas. Do mesmo modo, anti-inflamatórios não esteroidais são contraindicados na úlcera péptica e devem ser evitados nas insuficiências cardíaca, renal ou hepática e na hipertensão arterial mal controlada.
A migrânea, seja em sua manifestação clássica de dor de cabeça ou, quando se apresenta primariamente com queixa vestibular, com frequência desencadeia sintomas de mal-estar, enjoo e vômitos. Essa sintomatologia aumenta de maneira significativa o desconforto do paciente em crise e, por isso, deve ser manejada com eficiência. Várias são as classes de substâncias com poder antiemético. Dentre elas, na abordagem dos sintomas concorrentes à cefaleia e/ou à manifestação vestibular, as mais usadas são os antagonistas da serotonina 5-HT3 (ondansetrona), os antagonistas dos receptores dopaminérgicos de ação central (metoclopramida, prometazina, domperidona), os anti-histamínicos (dimenidrato, meclizina e prometazina) e os anticolinérgicos (escopolamina, dimenidrato). Do mesmo modo, seu perfil de efeitos colaterais e contraindicações deve ser a base da escolha para uso em determinado paciente, e sempre pelo menor tempo e dose possíveis.
Com relação aos sintomas vestibulares em pacientes migranosos, ressalta-se – antes de tudo, que se trata de situação frequentemente incapacitante e, por isso, deve ser encarada de modo assertivo e criterioso. Por advir, em linhas gerais, de um desequilíbrio das aferências e eferências vestibulares em seus mais distintos níveis, são tratados na fase crítica com a supressão conscienciosa da atividade vestibular. Aqui, torna-se imprescindível a titulação da medicação caso a caso, prevenindo-se doses excessivas que provoquem desnecessária sedação ou prejudiquem demasiadamente a função vestibular basal – com resultado contraproducente. As principais classes de medicações utilizadas são os bloqueadores de canais de cálcio (flunarizina, cinarizina), os anti-histamínicos e os benzodiazepínicos (alprazolam, clonazepam). O uso prolongado em altas dosagens deve ser evitado sob o risco de efeitos adversos indesejáveis como aumento do risco de quedas, sedação, ganho de peso, sintomas extrapiramidais, alteração do metabolismo de carboidratos e lipídeos e depressão.
O tratamento crônico deve ser considerado em todos os pacientes. Isso porque medidas não-farmacológicas gerais são universalmente válidas e apresentam baixos riscos. Deve-se priorizar instruir o paciente a uma vida com hábitos saudáveis, incluindo higiene do sono, prática de atividade física, alimentação balanceada e manejo do estresse. Condutas proibitivas ortodoxas devem ser ponderadas criteriosamente, de modo a não incorrer em privações e ansiedades desnecessárias. Assim, de maneira secundária, o paciente deve ser orientado a perceber seus fatores particulares pontuais de piora e apenas privar-se daqueles cuja retirada tenha se mostrado notadamente benéfica.
Já o uso de medicações preventivas como parte desse tratamento será importante apenas em uma fração dos indivíduos. De modo geral, seu uso está indicado naqueles com crises frequentes e/ou incapacitantes. Aqui, há várias classes de medicações disponíveis, com mecanismos de ação, contraindicações e efeitos colaterais muito particulares (Tabela 3). Entre elas, podemos citar anti-hipertensivos (propranolol, candesartana), anticonvulsivantes (topiramato, ácido valpróico), bloqueadores de canais de cálcio (flunarizina, verapamil), tricíclicos (amitriptilina, nortriptilina), inibidores de recaptação de serotonina e noradrenalina (venlafaxina) e antagonistas da serotonina (pizotifeno e ciproheptadina). A miríade de drogas que se mostraram em algum grau eficazes na profilaxia da migrânea é um reflexo da sua complicada fisiopatologia. Isso significa que a atuação em diferentes elos do intrincado mecanismo das manifestações migranosas é capaz de – em pelo menos um subgrupo de pacientes, reduzir sua ocorrência e intensidade. Ainda pouco é sabido sobre as especificidades de cada uma dessas classes medicamentosas quando usadas na migrânea e são desconhecidas populações particulares de pacientes que se beneficiariam mais de uma classe em detrimento de outra. No entanto, devido ao seu uso para tratamento de outras doenças e ao perfil de efeitos colaterais por vezes desejável em alguns casos, em determinado paciente uma classe pode mostrar-se preferencial como primeira escolha de tratamento. Nessa escolha, contudo, é fundamental levarmos em consideração as contraindicações e os efeitos adversos que, quando existentes, costumam ser proibitivos – ainda que a medicação aparentasse ser a mais indicada inicialmente.
|
Classes de medicamentos utilizadas na profilaxia da migrânea |
||
|
Mecanismo |
Exemplos |
|
|
Anti-hipertensivos |
Beta-bloqueadores |
Propranolol, metoprolol, timolol, atenolol |
|
Inibidores da enzima conversora de angiotensina (IECA) |
Lisinopril |
|
|
Antagonistas do receptor de angiotensina II |
Candesartan |
|
|
Bloqueadores de canais de cálcio |
Verapamil |
|
|
Antidepressivos |
Tricíclicos |
Amitriptilina, nortriptilina |
|
Inibidores da receptação de serotonina e noradrenalina |
Venlafaxina, duloxetina |
|
|
Anticonvulsivantes |
Valproato de sódio, topiramato |
|
|
Bloqueadores de canais de cálcio |
Flunarizina |
|
|
Antagonistas da serotonina e da histamina |
Pizotifeno, ciproheptadina |
|
|
Nutracêuticos |
Coenzima Q10, riboflavina, magnésio |
|
Tabela 3: Principais classes medicamentosas utilizadas na profilaxia da migrânea.
Todas as medicações profiláticas para a migrânea devem ser iniciadas na menor dose possível e tituladas lentamente até que se atinja uma dose terapêutica confortável. Em situações de migrânea vestibular, é bastante comum observar-se uma resposta favorável com baixas doses. Na ausência de resposta com doses terapêuticas ou diante da ocorrência de efeitos adversos impeditivos ou persistentes, é possível a troca da medicação por outra de classe diferente. Devido à diversidade de mecanismos de ação dos fármacos, essa substituição não enseja necessariamente mau prognóstico com o novo plano terapêutico. Na presença de resposta eficaz, o tratamento deve ser mantido por período individualizado. Não há período mínimo bem estabelecido para o uso da profilaxia, mas acredita-se que, após cerca de 12 meses de uso, pode ser tentada a redução seguida de interrupção da medicação. No caso de recaídas, a retomada progressiva do uso anterior faz-se necessária e não implica em prejuízo da resposta em longo prazo.
Consoante ao seguimento de uma doença crônica, os distúrbios relacionados à migrânea devem ser periodicamente reavaliados. Nesse acompanhamento, o médico deve observar a evolução da frequência e magnitude das crises, a resposta individualizada para cada manifestação migranosa apresentada, o surgimento de intercorrências que justifiquem refratariedades e a adaptação e adesão ao tratamento crônico. Ferramentas objetivas como o DHI (Dizziness Handicap Inventory) e o VM-PATHI (Vestibular Migraine Patient Assessment Tool and Handicap Inventory) podem ser utilizadas como maneira de parametrizar a evolução longitudinal de cada caso. É salutar que sejam pesquisadas e controladas as expectativas do paciente, evitando-se promessas de cura. Estabelecer objetivos reais de redução do número e intensidade dos episódios, introjetar os conceitos mais factíveis de controle e remissão da doença, promover o autoconhecimento e reforçar o papel do paciente na manutenção de hábitos que favoreçam a resposta terapêutica são fundamentos desse seguimento.
Outro ponto importante do tratamento de pacientes migranosos é identificar e manejar de modo eficaz e oportuno eventuais complicações relacionadas ao quadro. Classicamente, em relação às cefaleias, são bem descritas a dor de cabeça por abuso de medicações e a migrânea crônica. No caso da migrânea vestibular, é essencial atentar-se sobretudo para o surgimento para tontura postural perceptual persistente (TPPP) associada e a ocorrência de vertigem posicional paroxística benigna intercorrente.
Por fim, o controle de comorbidades diretamente envolvidas na piora da sintomatologia do paciente migranoso é outro ponto crucial. Aqui, ressaltam-se as alterações hormonais, os distúrbios do sono, as síndromes dolorosas crônicas, os distúrbios metabólicos e os transtornos do humor. Para as manifestações vestibulares, em específico, é preciso cuidar de doenças concomitantes, como a doença de Ménière e a cinetose.
Em suma, pode-se dizer que o cuidado ao paciente com migrânea deve ser amplo, meticuloso e de longo prazo. Ainda, a visão biopsicossocial do processo de saúde-doença, a individualização dos planos terapêuticos e o foco do acompanhamento no indivíduo em detrimento de alterações pontuais em sistemas isolados tendem a enriquecer e melhorar a assistência médica ofertada. Estar atento às novidades diagnósticas e de tratamento é uma atitude necessária, entretanto, as novas tecnologias não podem jamais sobrepujar os princípios do atendimento médico completo, humano e bem executado.
Referências:
Patrícia Mauro Mano
O processo natural de oxidação nada mais é do que reação entre o oxigênio obtido na respiração celular e outros elementos químicos presentes no organismo. O processo leva à perda de elétrons.1 Radicais livres, ou espécies reativas de oxigênio (ROS), são as moléculas que recebem esses elétrons livres após a reação química para formação de energia. A produção de radicais livres, não apenas é fundamental para a geração de energia, como também é essencial para o bom funcionamento do organismo.
As reações de oxidação são normalmente controladas pelo nosso corpo, que mantém o equilíbrio salutar entre a produção de radicais livres e a de compostos antioxidantes. Os antioxidantes impedem que a célula e, consequentemente, o organismo como um todo, sofra a ação maléfica das espécies reativas de oxigênio. Essas espéciesinduzem à lesão celular e, muitas vezes, à apoptose.2
Diversos motivos podem promover um desbalanço nessa equação, com consequente aumento da produção de radicais livres e menor produção de antioxidantes. Má alimentação com desnutrição celular, exposição constante a poluentes e metais pesados e a contaminação de pesticidas nos alimentos e na água são algumas delas. Quando a produção de radicais livres pelo corpo supera a produção de antioxidantes, ocorre o que chamamos de estresse oxidativo.1
O estresse oxidativo não é necessariamente maléfico ao nosso organismo. Situações como produção de massa muscular em praticantes de atividade física ou mesmo a ativação do nosso sistema imunológico necessitam de estresse oxidativo para acontecer. Consideramos o estresse oxidativo maléfico quando o seu descontrole resulta em danos aos sistemas biológicos. Assim também acontece nas disfunções do sistema vestibular.
Por meio de pesquisa no banco de dados PubMed, identificamos diversos artigos científicos que demonstram a influência do estresse oxidativo nos diferentes diagnósticos otoneurológicos.
Ohara et al1, em 2014, demonstrou que pacientes com tontura, com diferentes diagnósticos, apresentam maior produção sérica de espécies reativas de oxigênio (ROS) e menor atividade do sistema parassimpático. Tais achados desaparecem quando o sintoma é controlado.
A Tontura Postural Perceptual Persistente (TPPP), antiga tontura crônica subjetiva (TCS), é uma condição inicialmente descrita por Staab3. Sua descrição explica condições patológicas específicas de tontura persistente, não vertiginosa, que geralmente pioram com a estimulação em que possuem estimulação visual intensa ou pistas visuais conflitantes.
Estudos anteriores tentaram revelar uma causa fisiopatológica precisa para a TPPP. No entanto, a doença geralmente é causada por interações entre elementos otoneurológicos e comportamentais, dificultando seu diagnóstico para grande parte dos médicos.4 Ainda sim, a relação entre TPPP e condições psiquiátricas, como depressão, é bem estabelecidada e documentada.3
Estudos recentes do tipo metanálise correlacionam condições psiquiátricas, como a depressão, com o aumento do estresse oxidativo, ativação da micróglia e a neuroinflamaçao5. Sendo assim, é possível fazer a ponte entre a TPPP e tais achados.
Fang et al4 verificou, em um artigo publicado em 2020, o status dos componentes antioxidantes endógenos, citocinas pró-inflamatórias e a dosagem de hormônios do estresse e de serotonina em pacientes com diagnóstico de TPPP. Esses pacientes foram comparados com um grupo controle, para encontrar possíveis marcadores que auxiliassem no diagnóstico desta condição. Os autores observaram que a atividade de enzimas antioxidantes estava significativamente diminuída nesses pacientes, enquanto citocinas pró-inflamatórias, como TNF-α e IFN-γ, encontravam-se significativamente aumentadas no grupo com diagnóstico de TPPP. Os resultados demostraram ainda elevação significativa de cortisol e adrenalina, bem como redução da serotonina no grupo com TPPP em comparação ao grupo saudável. Com base nos dados, Fang et al.4 concluiu que o estresse oxidativo está envolvido na TPPP.
A doença de Ménière (DM) foi descrita pela primeira vez por Prosper Ménière em 1861. Trata-se de uma síndrome clínica caracterizada por episódios de vertigem espontâneos que duram minutos a horas, geralmente associados à perda auditiva sensorioneural flutuante, em frequências graves, associada ou não a zumbido e sensação de plenitude auditiva, em uma ou ambas as orelhas.6
A fisiopatologia da DM está associada ao acúmulo de endolinfa no ducto coclear e nos órgãos vestibulares. Embora um terço dos casos de DM possa apresentar disfunção do sistema imunológico, a resposta imune em pacientes com DM tem sido pouco investigada.6
Estados alérgicos são estados pró inflamatórios. A ligação entre alergia e DM foi descrita pela primeira vez por Duke em 19237. Em 2000, Derebery8 conduziu estudos epidemiológicos em pacientes com DM e observou que 58% dos pacientes possuíam histórico de alergia e 41% apresentaram teste cutâneo positivo.
Tanto os alérgenos inalatórios quanto alimentares têm sido associados à DM. Em um estudo não controlado, Topuz et al9 mostrou que o teste cutâneo pode induzir sintomas auditivos, como zumbido ou sensação de plenitude auditiva em 62% dos pacientes. Nesses casos, 77% dos indivíduos apresentaram aumento da pressão endolinfática medida por eletrococleografia. Os resultados do estudo sugerem que certos alérgenos podem induzir à hidropisia endolinfática.
Conforme constatado por Frejo et al.,6 quando comparados aos controles, os pacientes com DM apresentaram expressão maior de citocinas pró inflamatórias como IL-1β, TNF-α e IL-6. Em indivíduos saudáveis, os níveis de IL-1 β geralmente são indetectáveis. Nenhum dos pacientes que apresentavam citocinas pró-inflamatórias elevadas possuía infecção aguda ou outra condição autoimune que pudesse explicar essa descoberta. O autor sugere que este subconjunto de pacientes com DM e altos níveis basais de citocinas e autoanticorpos negativos pode ser considerado como portador de uma condição auto inflamatória que envolve a orelha interna. As características da doença auto inflamatória da orelha interna podem incluir uma resposta imune inata mediada por monócitos, altos níveis de IL-1β e títulos baixos/ autoanticorpos inespecíficos.6
O estudo em questão demonstrou que alguns extratos alergênicos induzem uma resposta imune pró-inflamatória na maioria dos pacientes com DM, envolvendo TNF-α, o que não é observado nos controles. Esse mecanismo poderia iniciar ou exacerbar a resposta inflamatória no saco endolinfático ou no ligamento espiral e desencadear a hidropisia endolinfática.6 Estudos anteriores também estabeleceram relação entre extratos de mofo e citocinas pró-inflamatórias na doença autoimune da orelha interna.10
Frejo et al.,6 em seu estudo, também referiu que pacientes que utilizaram imunoterapia apresentaram melhora na duração e frequência dos episódios de vertigem em comparação com os controles, e que, essa poderia ser uma alternativa de tratamento para alguns pacientes com DM.
A enxaqueca Vestibular (EV), assim como a DM, também é uma síndrome otoneurológica episódica definida por um conjunto de sintomas como vertigem, zumbido e plenitude auditiva. Tanto a EV quanto a DM podem apresentar sobreposição de sintomas e não há um marcador biológico conhecido para distingui-las. A principal diferença nos critérios de diagnóstico entre essas duas condições são os sintomas auditivos, que são necessários para o diagnóstico de DM definitiva.
Ainda sim, está relatado que pacientes com EV podem apresentar zumbido durante as crises de vertigem, e ainda que 25% dos pacientes com enxaqueca sofrem de perda auditiva. Cabe ainda lembrar que é observada uma alta prevalência de enxaqueca em pacientes com DM, sugerindo uma ligação fisiopatológica entre essas doenças.11
Flook et al,12 em 2019, se propôs a investigar o perfil de citocinas pró-inflamatórias nos pacientes com diagnóstico de DM e EV, com o objetivo de distinguir laboratorialmente essas patologias. Como já previamente descrito por Ohara1, Flook12 também observou que os controles sempre têm níveis de citocinas mais baixos do que os pacientes. Isso poderia indicar que os pacientes com MD e VM apresentam uma resposta pró-inflamatória sistêmica, justificando a resposta de alguns pacientes a medicamentos anti-inflamatórios. Por outro lado, esse aumento na produção de citocinas também poderia transparecer atividades que estão ocorrendo no interior da orelha interna. Atividades resultantes de uma resposta inflamatória prolongada que pode acarretar danos a esta estrutura por meio da ruptura do seu epitélio. Apesar de apresentar uma coorte de pacientes limitada, o autor conclui que pacientes com MD e VM possuem uma assinatura pró-inflamatória diferente e, que um painel de citocinas poderia ser usado como marcadores biológicos para o diagnóstico diferencial entre VM e MD.12
A vertigem posicional paroxística benigna (VPPB) é considerada a disfunção vestibular periférica mais comum. É caracterizada por episódios recorrentes de vertigem com duração de segundos desencadeados por movimentos da cabeça.13 O mecanismo fisiopatológico subjacente à VPPB está relacionado à presença de detritos/otólitos flutuantes no canal semicircular (canalolitíase) ou aderidos à cúpula (cupulolitíase). Acredita-se que esses otólitos se acumulem após desprendimento do neuroepitélio da mácula utricular após degeneração da estrutura, conforme aspecto observado em microscopia eletrônica. Qualquer circunstância que promova a degeneração deste epitélio parece ser capaz de causar a VPPB.14
A VPPB é considerada idiopática em cerca de 80% dos casos.13 Ainda que se aceite que o motivo do sintoma são os otólitos soltos fora de seu lugar, e que a melhora sintomática somente ocorra por meio das manobras de reposição, a pergunta que não pode deixar de ser feita é: o que gerou um processo de degeneração do epitélio macular a ponto dessas partículas se desprenderem?
Em uma revisão sistemática, Yetiser14 identificou alguns possíveis fatores associados à ocorrência de VPPB, como envelhecimento, enxaqueca, doença de Ménière, infecção, insuficiência de vitamina D, hiperglicemia e doenças autoimunes.14
Como já discutido anteriormente, o ponto em comum entre todas essas condições é o estresse oxidativo. O aumento descontrolado da formação de radicais livres causa danos endoteliais, sofrimento do neuroepitélio macular e consequente ativação de vias de sinalização apoptóticas. O desprendimento dos otólitos ocorre devido à fragilidade da superfície macular.13
Mesmo com toda a evidência que ligue os sintomas vestibulares ao estresse oxidativo, muitos estudos ainda serão necessários para nos orientar na melhor condução desses casos. Promover a limpeza ou retirada de radicais livres de nosso organismo, por meio do uso de antioxidantes exógenos, apresenta resultados limitados em comparação ao combate de sua formação, promovendo a produção de antioxidantes endógenos.
Assim, a avaliação preventiva da nutrição celular, o cuidado com o descanso e a qualidade de sono, bem como o estímulo a prática frequente de atividade física apresentam resultados promissores. Esses resultados são visíveis não apenas no controle de doenças instaladas, mas também na melhora da qualidade de vida de nossos pacientes. Esse é um campo vasto, que abre portas para uma medicina integrativa, que aborde o paciente como um todo.
Referências:
Dr Rodrigo Guizardi
Disciplina de ORL da Faculdade de Medicina da Universidade de Marília – SP
A Barreira Hematolabiríntica (BHL), assim como a Barreira Hematoencefálica (BHE), é uma estrutura fundamental para homeostase da orelha interna/SNC e já amplamente pesquisada na medicina moderna. É uma interface entre os órgãos periféricos e o SNC e controla seletivamente a troca de substâncias entre eles, mantendo o equilíbrio bioquímico e fisiológico no ambiente intersticial e celular.
Os principais atores das BHL e BHE são as células e junções endoteliais compactas que revestem os vasos sanguíneos e permitem apenas a passagem de pequenas moléculas lipossolúveis, gases e íons. Outras moléculas maiores, como a glicose, dependem de canais específicos. Portanto fica clara a importância dessas barreiras para adequada fisiologia dos fluídos, íons, moléculas e do equilíbrio oxidativo das vias auditivas e labirínticas.
Classicamente, as doenças da orelha interna, como Meniere, VPPB, neurites e perdas auditivas, são amplamente estudadas como entidades distintas, seus respectivos mecanismos fisiopatológicos, fatores de risco e opções terapêuticas. A análise atenta desses estudos e de vasta literatura sobre fisiologia, bioquímica e bases fisiopatológicas das doenças crônicas que acometem o corpo humano, demonstra um ponto convergente entre todas elas: a inflamação crônica estéril, também denominada inflamação crônica de baixo grau.
Caracteristicamente essa inflamação apresenta um curso longo, por vezes silencioso e com uma grande dissociação de sinais e sintomas. Por suas características, por muitas vezes a inflamação passa despercebida diante da visão médica tradicional não integrativa. A má alimentação, disbiose, o estresse com desregulação do eixo Hipotálamo-Hipófise-Adrenais, sobrepeso/obesidade, sedentarismo, tabagismo, poluição e intoxicação por metais pesados são exemplos dos grandes catalisadores do processo.
O desequilíbrio da cascata inflamatória, com a liberação persistente de citocinas inflamatórias, provoca um incremento significativo do estresse oxidativo, desorganização funcional celular, lesão tissular e do DNA. Sendo assim, é fácil entender a base fisiopatológica de múltiplas patologias que a medicina tradicional enxerga e trata como entidades distintas. Entre esses diagnósticos estão a aterosclerose, câncer, a neurodegeneração, artroses, cardiopatias, DPOC, asma, sinusite crônica, assim como as doenças otoneurológicas.
Ao revisar as publicações sobre fatores de risco relacionados a doenças da orelha interna, encontramos uma significativa quantidade de referências a distúrbios metabólicos. Entre eles a diabetes, hiperinsulinemia, tireoidopatias, dislipidemias, autoimunidade, vírus, drogas ototóxicas, ruído, SAHOS, hipovitaminoses, disbiose, etc…
A questão é: Mas afinal, há um elo comum entre todos eles?
E a resposta é: Sim! A inflamação crônica estéril/estresse oxidativo com a possível disfunção da barreira hematolabiríntica.
Revendo a literatura específica, citamos alguns estudos que sugerem a interrelação entre as doenças da orelha interna e o processo inflamatório crônico:
A propósito deste assunto, é de grande importância para o médico otorrinolaringologista a visão integrativa sistêmica da relação entre a disbiose, BHL e neuroinflamação crônica estéril. Essa associação pode ser observada no organograma que segue.
Uma interessante publicação do Word Journal of Otorhinolaryngology em 2013, a respeito da perda auditiva neurossensorial súbita idiopática, busca integrar as diversas hipóteses diagnósticas da perda auditiva. Em todas elas os autores encontram o “estresse” como gatilho para o desequilíbrio do sistema imunológico com a liberação de citocinas, ativação inadequada do eixo Hipotálamo-Hipósise-Adrenais e do sistema nervoso autônomo, que impactam negativamente na fisiologia coclear. Nesse caso a ativação do NFKB pode ser a via de convergência entre os “estressores sistêmicos”.
O estresse oxidativo também foi atribuído aos pacientes com VPPB, em um artigo de 2018 do The Journal of International Advanced Otology. Nesse estudo, 62 pacientes foram divididos em 2 grupos (saudáveis e VPPB) e no grupo VPPB foi observada a maior prevalência do status inflamatório, por ação direta dos radicais livres e desbalanço metabólico do cálcio. A propósito, vale a pena lembrar que os otólitos são formados por carbonato de cálcio, cujas fracas ligações são muito mais sensíveis ao estresse oxidativo e às variações de ph. Os ossos, por outro lado, são formados por fosfato de cálcio, cujas ligações mais fortes são, possivelmente, fruto evolutivo da exigência muscular.
Creio que uma melhor compreensão sobre a inflamação crônica estéril, seus gatilhos e mecanismos fisiopatológicos, que repercutem nos diversos sistemas orgânicos, trará definitivamente uma mudança de olhar do médico em relação às doenças, bem como uma fabulosa ampliação no arsenal de “ferramentas terapêuticas”.
REFERÊNCIAS BIBLIOGRÁFICAS
Abbott N. Inflammatory mediators and modulation of blood-brain barrier permeability. Cell Mol Neurobiol 2000; 20:131-147. {Google Scholar} {Cross Ref} {PubMed}.
CryanJF; DinanTG. Mind-altering microorganisms: The impacto f the gut microbiota on brain and behaviour. NatRev Neurosci 2012; 13:701-712.
Ishiyama, Gail “et al”. Estresse oxidativo no sangue. Barreira labiríntica na mácula. Utrículo de pacientes com Doença de Ménière. Frontiers in Physiology 2018, 9:1068.
Karzaki, Jin; Masuda, Masatsugu. Causa da perda auditiva neurossensorial súbita idiopática: A teoria da resposta ao estresse. Word Journal of Otorhinolaryngology 2013, Japan. 3: 42-57.
Kociszeuska, Dagmara; “et al”. A ligação entre disbiose intestinal causada por uma dieta rica em gordura e perda auditiva. Jornal Internacional de ciências ortomoleculares 2021, vol 22.
Megantara, Sacerdote. O papel da disbiose intestinal na fisiopatologia do zumbido: Uma revisão da literatura. ITJ, 2022, vol 26.
O’Mahony, S.M.; Clarke, G.; Borre, Y.E.; Dinan, T.G.; Cryan, J.F. Serotonin, tryptophan metabolismo and brain-gut-microbiome axi. Behav. Brain Res 2015, 277:32-48.
Rothhammer V, Mascanfroni ID, Bunse L, Takenaka MC, Kenison JE, Mayo L, et al. Type I interferons and microbial metabolites of tryptonphan modulate astrocyte activity and central nervous system inflamation via the hydrocarbon receptor. Nat Med 2016; 22:586-97.
Sahim, Ethem “et al”. Estado oxidatro em pacientes com vertigem posicional paroxística benigna. The Journal of Internacional Advanced Otology 2018, 14:02.
Smith R S. The macrophage theory of depression. Medical Hypotheses 1991;35(4):298-306.
Wohleb E S, McKim D B, Sheridan J F, Godbout J P. Monocyte trafficking to the brain with stress and inflammation: a novel axis of imune-to-brain communication that influences mood and behavior. Front Neurosci 2014; 8:447.
Lucas Resende L Mangia
Departamento de Otorrinolaringologia e Oftalmologia da Universidade Federal do Paraná (UFPR)
A relação entre os níveis dos hormônios sexuais femininos e o funcionamento do sistema vestibular é descrita de diferentes maneiras na literatura médica. Assim, há estudos que mensuram – tanto por meio de parâmetros da função vestibular quanto pela ocorrência de sintomas clínicos, os efeitos das flutuações do estradiol e da progesterona nas vias relacionadas ao equilíbrio e à percepção espacial. Esses estudos demonstram variabilidades de aspectos funcionais e clínicos de acordo com a fase do período menstrual.1–6
O climatério é uma fase da vida da mulher caracterizada por uma transição hormonal frequentemente acompanhada por sintomatologia diversa. Ocorre entre a vida reprodutiva e a senescência e é altamente variável em seus aspectos temporais e clínicos. Possui idade de início, duração, tipos de manifestações e intensidade muito individualizadas.
Do ponto de vista hormonal, é caracterizado por duas tendências principais. A primeira é de queda longitudinal dos níveis do estradiol e da progesterona que estarão, ao final do período, bastante reduzidos em comparação à fase reprodutiva que o antecede. A segunda é de flutuação desses índices, de maneira que a queda longitudinal não é linear nem uniforme. Apresenta, além das variações próprias do ciclo menstrual, flutuações ciclo a ciclo e de indivíduo para indivíduo (Figura 1).
Figura 1: Esquema das tendências longitudinais dos níveis dos principais hormônios sexuais femininos ao longo da vida da mulher. No climatério, em destaque, há redução progressiva não linear dos níveis hormonais. Fonte: o Autor.
Clinicamente, a gama de sintomas relacionados ao climatério é ampla (Tabela 1) e também muito particular a cada paciente, possivelmente por representarem manifestações de vulnerabilidades individuais. Assim, a presença de ciclos irregulares e os sintomas vasomotores – tipicamente fogachos e sudorese noturna, são os mais típicos. Contudo, alterações de humor, prejuízo cognitivo, tendência ao acúmulo de gordura abdominal, piora da qualidade do sono, dores musculares e ósteo-articulares e cefaleia são também frequentemente reportados.7
| Sintomas comumente relatados no climatério | |
| Fogachos e suores noturnos | Tontura |
| Ciclos menstruais irregulares | Fadiga |
| Alterações do humor: labilidade emocional, ansiedade, nervosismo, irritabilidade. | Dores ósteo-articulares |
| Déficits cognitivos: prejuízo da atenção, lapsos de memória, perda da concentração. | Atrofia da mucosa urogenital: dispareunia, coceira vaginal, disúria |
| Ganho de peso | Palpitações |
| Insônia | Diminuição da libido |
| Dores de cabeça | |
Tabela 1: Sintomas mais comuns durante o climatério.
Sintomas vestibulares são muito prevalentes em mulheres durante a transição climatérica. Entretanto, apesar das descrições em inquéritos de até 60% de ocorrência de tonturas nesse período, trata-se de uma sintomatologia largamente negligenciada.8–10 Assim, há poucos estudos clínicos sobre o assunto e as escalas, protocolos e diretrizes direcionados ao climatério infelizmente desprezam o quadro vestibular. Pesquisas em bases de dados da literatura médica, por exemplo, retornam escassos estudos focados no tema e, aqueles existentes, lidam com o quadro vestibular de modo superficial e inespecífico. Assim, pouco se sabe até então sobre as características semiológicas da tontura relatada durante o climatério, as doenças envolvidas e suas repercussões funcionais no labirinto e vias vestibulares centrais. Por outro lado, estudos preliminares registram o impacto significativo da queixa de tontura na mulher climatérica em diferentes domínios de avaliações de qualidade de vida.11 Como resultado, tais pacientes sofrem por terem seus sintomas minimizados, ignorados ou atribuídos vagamente a quadros emocionais.
Até o momento, as bases fisiopatológicas que regem a relação entre tontura e climatério estão escassamente elucidadas. O tema é complexo, pois abarca intrincada rede de fatores possivelmente envolvidos e vieses de confusão a serem ponderados. Além disso, as informações advindas de estudos clínicos não são inequívocas e estão comumente contaminadas pela heterogeneidade das populações estudadas e dos dados coletados. Ainda, deve-se sublinhar que os estudos pecam por dissecarem superficial e insuficientemente as queixas vestibulares apresentadas pelas mulheres avaliadas – limitando a proposição de inferências sólidas no que tange o assunto.
Dessa maneira, o alicerce do conhecimento atual em relação à matéria advém de estudos eminentemente de ciências básicas, a nível celular e tecidual, que são reforçados por investigações em modelos animais. Em suma, pode-se compreender o climatério como um estado de transição neurológica em que, à semelhança da puberdade, uma série de vias regulatórias complexas do organismo da mulher são ativadas ou inativadas. Essa reorganização fisiológica, por sua vez, predispõe à manifestação de vulnerabilidades individuais de diferentes sistemas orgânicos – que resultariam, em última análise, na eclosão de sintomas e síndromes particulares a cada mulher durante o período.12
Figura 2: Esquema demonstrando os efeitos do estradiol, e consequentemente de sua redução, sobre o metabolismo energético no sistema nervoso central. Fonte: o Autor.
De maneira mais específica e sobre base científica sólida, três mecanismos principais podem ser aventados para explicar o impacto das flutuações e reduções dos hormônios sexuais femininos – em especial o estradiol, nas diversas instâncias do sistema vestibular. Em primeiro lugar: o estradiol regula o metabolismo energético celular no sistema nervoso central. Nesse tecido, a fonte de energia primária é a glicose que, transportada para o interior da célula, sofre catabolismo aeróbio para geração de energia. Sob efeito estrogênico, o transporte intracelular de glicose é otimizado e a eficiência energética da célula aumenta. Em contrapartida, diante de índices séricos reduzidos desse hormônio, o tecido nervoso passa a utilizar substratos alternativos, como ácidos graxos e corpos cetônicos, com limitação da produção de energia (Figura 2).13 Assim, pode-se considerar que a transição climatérica implicaria na emersão de um estado hipometabólico no sistema nervoso central, com possível prejuízo secundário de atividades de alta demanda, como processamento de informações complexas, integração de aferências e resposta rápida a estímulos intercorrentes. Em segundo lugar: deve ser lembrado que o estradiol – mediante ligação ao seu receptor celular, promove efeitos diversos que pendem o equilíbrio entre vias pró- e anti-inflamatórias do organismo em favor da inibição da inflamação tecidual. Esse efeito é mediado, entre outros, pela estimulação do eixo hipófise-adrenal, da produção de óxido nítrico e da formação de antioxidantes. Além disso, a função linfocitária e a produção de citocinas inflamatórias, como a interleucina 6 e o fator de necrose tumoral alfa, são coibidas.14 Consequentemente, diante dos níveis hormonais decrescentes do climatério, ocorre um estado pró-inflamatório – capaz de engatilhar ou aguçar comorbidades vestibulares diversas. Por fim: cumpre ressaltar o efeito direto e particular do estradiol no sistema vestibular e perceptual. Nesse sentido, sob ação estrogênica observa-se incentivo à plasticidade sináptica em regiões como o cerebelo e o hipocampo, sensíveis à ação desse hormônio e fundamentais na modulação da aferência labiríntica e processamento perceptual, respectivamente.15 Essa estimulação envolve a ativação celular de fatores de transcrição gênica relacionados à produção de neurotrofinas como o fator neurotrófico derivado do cérebro (BDNF, do termo em inglês).16 Uma menor densidade sináptica em vestíbulo-cerebelo concorrente à supressão estrogênica pode implicar em prejuízo da modulação reflexo vestíbulo-ocular (RVO), uma vez que esse arco reflexo é finamente ajustado por fibras de Purkinje.15
Dessa maneira, os mecanismos que podem explicar o impacto dos hormônios sexuais femininos, em especial o estrógeno, no sistema vestibular da mulher durante o climatério envolvem, resumidamente:
Ainda que incipientes, estudos clínicos também lançam luz sobre a associação entre tontura e climatério e sobre as bases fisiopatológicas dessa relação. Estudos dos sintomas climatéricos por análise de agrupamentos (clusters) colocam a tontura à parte dos sintomas vasomotores e psicológicos, assim como outras manifestações consideradas “atípicas”.17 Esse achado prenuncia uma fisiopatologia própria e muito provavelmente multifatorial para o sintoma. Por outro lado, há investigações que reforçam o vínculo da queixa vestibular com algumas queixas climatéricas, salientando possíveis elos fisiopatológicos entre elas e os efeitos dos hormônios sexuais femininos no aparato vestibular. Desse modo, o rastreio positivo de ansiedade pela escala HADS (Hospital Anxiety and Depression Scale) foi significativamente relacionado à ocorrência de tontura entre mulheres climatéricas.18 Além disso, a presença de sintomas vasomotores nessas mulheres também foi associada de maneira significativa à ocorrência de queixas de tontura e instabilidade postural e à menor taxa de recuperação após síndrome vertiginosa.19
Com relação às disfunções vestibulares estabelecidas, crescem paralela e lentamente as evidências que conectam a transição climatérica, sua manifestação e evolução. Para a doença de Méniere, por exemplo, foram reportados níveis séricos significativamente menores do estradiol em mulheres acometidas quando comparadas com controles pareadas pela idade. Ainda, encontrou-se correlação significativa, ainda que fraca, entre tais índices hormonais e o valor da predominância labiríntica – medida objetiva de assimetria vestibular na doença, obtida entre as pacientes estudadas.20
Similarmente, evidências conectam o climatério e a evolução das disfunções migranosas, como a migrânea vestibular. É sabido que tais condições são mais comuns em mulheres e que a perimenopausa é um período especialmente susceptível à sua manifestação. Além disso, os neuroesteroides ovarianos parecem regular sistemas neurotransmissores e o efeito de moléculas, como o peptídeo relacionado ao gene da calcitonina (CGRP, do termo em inglês), implicados na fisiopatologia dessas disfunções. Com a irregularidade e alargamento dos ciclos menstruais durante o climatério, o período de vulnerabilidade cíclica aos episódios de migrânea estão ampliados.21,22 Pesquisas clínicas começam a reforçar essa associação entre pacientes com migrânea vestibular. Nesse sentido, em pacientes pós-menopausa com a doença, os níveis do estradiol, da progesterona e da testosterona se mostraram significativamente reduzidos em comparação com controles. Além disso, entre pacientes com migrânea vestibular, aquelas com maiores concentrações do estradiol apresentaram menor gravidade do quadro, menor severidade, frequência e duração dos episódios de tontura reportados.23
Investigações em andamento nos serviços de Otoneurologia do Hospital de Clínicas da Universidade Federal do Paraná (HC-UFPR) e no Hospital das Clínicas da Universidade de São Paulo (HC-USP) têm procurado escrutinar as características dos quadros vestibulares episódicos em mulheres climatéricas. Ainda que preliminares, a experiência até o momento aponta para a correlação entre as escalas clínicas vestibulares e aquelas ligadas a esse período da vida da mulher (Figura 3). Tais observações sugerem um reforço indireto do impacto da transição hormonal nas vias vestibulares, e direciona para a existência de marcadores clínicos e laboratoriais para essa relação.
Figura 3: Gráfico de dispersão entre os valores obtidos para a escala clínica de avaliação de queixas vestibulares, Dizziness Handicap Inventory (DHI) e a escala de sintomas climatéricos, entre pacientes sintomáticas. Coeficiente de Pearson (r: 0,481) demonstra moderada correlação entre as variáveis. (Resultados preliminares do ambulatório de estudo de disfunções vestibulares episódicas no climatério, da Universidade Federal do Paraná). Fonte: o Autor.
Em suma, há demonstrações robustas da influência dos hormônios no sistema vestibular ao longo da vida da mulher. O climatério, por sua vez, é um período especialmente vulnerável à manifestação de disfunções neurológicas de ordem diversa, como a tontura. Essa propensão decorre de mecanismos complexos, neuromicroestruturais, bioenergéticos e inflamatórios, que conectam o estradiol ao funcionamento vestibular. Deve-se considerar, contudo, que o período apresenta comumente outras repercussões, como a piora do sono e alterações do humor, que indiretamente poderiam impactar os sistemas vestibular e perceptual. Ainda assim, investigações preliminares indicam repercussões significativas da transição hormonal climatérica em síndromes vestibulares conhecidas, que precisam ser melhor destrinchadas. Estudos em andamento e futuros possibilitarão impulsionar o conhecimento sobre o assunto, fomentar seu reconhecimento pelos profissionais de saúde e apontar caminhos para melhorar a abordagem e tratamento das pacientes com queixas vestibulares nessa fase da vida.
REFERÊNCIAS
Francisco Zuma e Maia
Considerada a vestibulopatia periférica mais prevalente, a Vertigem Posicional Paroxística Benigna (VPPB) é provocada por um distúrbio utricular, onde partículas de carbonato de cálcio, acompanhadas ou não de massa otoconial, deslocam-se para dentro dos canais semicirculares (CSC) da orelha interna, gerando uma diferença de densidade maior da endolinfa em relação à cúpula e exercendo fluxos endolinfáticos que estimulam os sensores ampulares dos CSC, de acordo com a movimentação cefálica e a ação gravitacional.
A melhor maneira de entendermos a fisiopatologia dessa doença biomecânica é recordarmos a anatomia e a fisiologia dos canais semicirculares, bem como sua relação com o órgão utricular (Fig. 01). Notem que todas as ampolas (onde se situam os epitélios neurossensoriais de todos os canais semicirculares) estão localizadas à frente. Isso nos facilita o entendimento da direção do fluxo endolinfático quando movimentamos a cabeça no plano dos canais. A VPPB é a patologia que melhor demonstra a segunda Lei de Ewald (fig 01). Ou seja, nos canais verticais, o fluxo ampulífugo (no sentido contrário da ampola) é excitatório e nos canais laterais o ampulípeto (no sentido da ampola) é que é o excitatório, sendo em todos os casos a direção da fase lenta do nistagmo.
Fig 01. Labirinto posterior direito. Leis de Ewald: Canais semicirculares verticais (posterior e anterior com seta indicando quando o fluxo é excitatório). Canal lateral com seta indicando quando o fluxo é excitatório. Cúpulas das cristas ampulares (C). Utrículo com a massa otoconial.
Cada canal excitado realiza um movimento ocular lento correspondente ao plano estimulado. Assim, os canais posteriores produzem um movimento lento torcional (horário) e vertical para baixo; os anteriores, um movimento torcional (anti-horário) e vertical para cima; e os laterais, um movimento horizontal (Fig 02). Lembrando que o movimento ocular de correção rápida é o que determina a direção do nistagmo.
Fig. 02. Labirinto posterior direito com os canais semicirculares e suas respectivas movimentações dos olhos de acordo com a sua estimulação. Nos canais posterior e anterior, os movimentos dos olhos são verticais e torcionais. No canal lateral, o movimento dos olhos é horizontal.
Quanto à intensidade e à latência do nistagmo, elas são diretamente proporcionais à quantidade e aos pesos das partículas flutuando dentro dos canais. Assim, quanto maior o número de partículas, menor a latência e maior a intensidade (1).
A VPPB pode ser diagnosticada através da Estratégia de Estímulo Mínimo, descrita por Asprella (2) e, na grande maioria dos pacientes, pode ser tratada com uma simples manobra física de reposicionamento dos otólitos de cada canal ao seu local de origem.
Como todas as patologias vestibulares, o elemento básico para o diagnóstico da VPPB está ancorado nos dados surgidos durante a anamnese. A VPPB é caracterizada por episódios de vertigem de curta duração (segundos) desencadeadas por movimentos cefálicos, geralmente na cama ou ao se levantar.
O grande desafio – e de fundamental importância – é sabermos de que lado e qual o canal afetado, ou seja: onde estão as partículas? E para isso devemos contar com alguns fatores importantes:
Fig. 03. Estratégia do Estímulo Mínimo. 1: procura de nistagmo pseudo-espontâneo; 2: Teste de Bow; 3: Teste de Lean; na ausência de nistagmo realizamos o 4: Teste de Dix-Hallpike, em que as partículas podem estar no canal posterior ou anterior. Caso nos passos 1, 2 e 3 apareça um nistagmo horizontal, realizamos o 5: Teste de Seated-Supine e o 6: Teste de Head-Roll.
Estando o paciente sentado, o primeiro passo é ver se ele apresenta um nistagmo pseudo-espontâneo (4) (e cerca de 20% dos pacientes apresentam), ou seja, aquele que muda de direção de acordo com os movimentos da cabeça. O segundo passo é flexionar a cabeça do paciente 60 graus (teste de Bow). O terceiro passo é estender a cabeça do paciente 60 graus (teste de Lean), sempre observando a intensidade e a direção do nistagmo. Por vezes, nos deparamos com um nistagmo vertical inferior e torcional no sentido horário após o teste de Bow e uma inversão do mesmo durante o teste de Lean. Nesses casos, estaremos diante da variante apogeotrópica do canal posterior, que deverá ser confirmada com o teste de Dix-Hallpike (Fig 04) (5).
Fig. 04. Provável localização dos movimentos dos otólitos baseada numa localização atípica no canal semicircular posterior direito em upright position; testes de Bow, Lean e Dix-Hallpike; C: cúpula; G: gravidade.
Na ausência de qualquer movimento nistágmico nos testes acima referidos, realizamos o teste de DIX-HALLPIKE, pois provavelmente as partículas de carbonato de cálcio (otólitos) se encontram no canal posterior (80%) ou no canal anterior (2%), evidenciando um nistagmo vertical superior e torcional no sentido anti-horário nos casos do canal semicircular posterior direito, ou vertical superior e torcional no sentido horário no esquerdo. Os movimentos dos nistagmos do canal anterior são caracterizados por um nistagmo vertical inferior e torcional na direção do lado afetado.
Se no primeiro passo encontrarmos um nistagmo espontâneo horizontal, dado a inclinação de 30 graus do canal lateral, podemos estar diante de duas situações: no primeiro caso, as partículas podem estar situadas no braço ampular (flutuando no canal ou grudadas na cúpula no lado do canal, ou na cúpula no lado do utrículo), e aí podemos visualizar um nistagmo na direção da orelha afetada; ou, diferentemente, no segundo caso, as partículas podem estar situadas no braço não ampular, resultando num nistagmo na direção do lado são. (Fig.05).
Fig 05. Direção do nistagmo pseudo-espontâneo de acordo com a provável localização dos movimentos dos otólitos nos braços ampular e não ampular.
Ao compararmos a intensidade e a direção do nistagmo durante o segundo e terceiro passos (BOW e LEAN respectivamente), caso o nistagmo seja de maior intensidade no teste de Bow do que no teste de Lean, estamos diante da chamada variante geotrópica, ou seja, as partículas estão localizadas no braço não ampular e sua direção nos mostra o lado afetado (Fig 06); ao contrário, se no teste de Lean o nistagmo for mais intenso do que no teste de Bow, estamos diante da variante apogeotrópica, ou seja, as partículas localizadas no braço ampular e também sua direção nos indicam o lado afetado. (Fig.07).
Fig 06. Direção e maior intensidade do nistagmo, com os otólitos localizados no braço não ampular durante os testes de Bow e Lean.
O quarto passo é deitar o paciente na posição supina (Seated-Supine position), onde teremos mais uma vez a confirmação do lado afetado e a localização das partículas. Nesse caso, a direção do nistagmo é para o lado são na variante geotrópica e do lado afetado na apogeotrópica.
Por último, realizamos o Teste de Head-Roll, onde mais uma vez vamos confirmar a localização das partículas, comparando a intensidade e a direção do nistagmo. Para aqueles que gostam de dicas, aqui se aplica uma delas: “as partículas estão localizadas no lado onde o nistagmo é mais intenso, e sua direção nos mostra o lado afetado”. (Fig.07).
Fig 07. Teste de Head-Roll nas variantes geo e apogeotrópico, mostrando a intensidade e a direção do nistagmo de acordo com o lado afetado.
TRATAMENTO
O tratamento da VPPB é realizado através das Manobras de Reposicionamento das partículas para o utrículo.
Para o canal semicircular posterior, damos preferência à manobra de EPLEY (Fig 08) (6).
Fig 08. Manobra de Epley para reposicionamento das partículas no canal posterior direito; I: Paciente sentado; II: Giramos a cabeça 45 graus para o lado afetado; III: Deitamos o paciente e seguramos sua cabeça em extensão de 30 graus, até que se esgote o nistagmo; IV: Giramos lentamente a cabeça 180 graus para o lado não afetado; V: Giramos a cabeça e o corpo mais 90 graus; VI: Inclinamos a cabeça, afim de posicionar o queixo no tórax, e VII: lentamente sentamos o paciente, sempre com a cabeça inclinada para frente.
Para o canal semicircular lateral de qualquer variante, usamos a Manobra de ZUMA (Fig.09 e 10) (7,8).
Fig 09. Manobra de Zuma para o reposicionamento das partículas na VPPB do canal lateral direito, estando as otocônias no braço ampular (variante Apogeotrópica). I: Paciente sentado; II: Deitamos o paciente para o lado afetado, usando a força da inércia e a desaceleração rápida, afim de deslocar possíveis partículas grudadas na cúpula (vemos um nistagmo horizontal batendo para o lado não afetado), aguardando o esgotamento do nistagmo; III: Giramos a cabeça 90 graus para cima usando uma rápida aceleração (neste momento, as partículas estão no braço não ampular, onde vemos um nistagmo horizontal batendo para o lado não afetado); IV: Giramos a cabeça mais 90 graus para o lado não afetado, para que as partículas se encaminhem do braço posterior para o utrículo, e para tratar aquelas que porventura estejam no braço curto e/ ou grudadas na cúpula do lado utricular (o nistagmo bate para o lado não afetado); V: Sentamos o paciente, com sua cabeça ligeiramente inclinada para frente, evitando que as partículas voltem para o canal.
Fig.10. Manobra de Zuma para o reposicionamento das partículas na VPPB do canal lateral direito, estando as otocônias no braço não ampular (variante Geotrópica). I: Paciente sentado; II: Deitamos o paciente para o lado afetado, usando a força da inércia e desaceleração rápida (vemos um nistagmo horizontal batendo para o lado afetado); III: Giramos a cabeça 90 graus para cima usando uma rápida aceleração (neste momento, há uma inversão do fluxo das partículas e do nistagmo em direção ao lado não afetado). A reversão do nistagmo nesse momento pode ser considerada indicador de bom prognóstico e sucesso da manobra; IV: Giramos a cabeça mais 90 graus para o lado não afetado, para que as partículas se encaminhem para o utrículo (vemos um nistagmo horizontal batendo para o lado não afetado ou mesmo a ausência do mesmo, quando as partículas já estão no utrículo); V: Sentamos o paciente, com sua cabeça ligeiramente inclinada para frente, evitando que as partículas voltem para o canal.
Para o canal semicircular anterior usamos a Manobra de YACOVINO (Fig.11) (9,10).
Fig. 11. Manobra de Yacovino para o diagnóstico e reposicionamento das otocônias na VPPB dos canais anteriores. I: Paciente sentado; II: Inclinamos a cabeça 45 graus; III: Deitamos o paciente mantendo a cabeça a 30 graus para fora da maca; IV: Inclinamos a cabeça 45 graus (não ultrapassar 15 segundos nessa posição, a fim de evitar switch de canal posterior); V: Sentamos o paciente inclinando ligeiramente sua cabeça para frente.
REFERÊNCIAS
Dr. Rogério Castro Borges de Carvalho
Bruna Gabriele Sartori Rodrigues dos Santos
Bruna Raísa Jennings da Silveira Soares
RELATO DE CASO
HISTÓRICO
Paciente de 49 anos, sexo feminino, queixando-se de vertigem posicional (ao deitar, levantar e rodar a cabeça para a esquerda quando em decúbito dorsal) com duração de segundos. Com início há cinco anos, apresenta em média um episódio ao ano, em crises que variam de uma semana a meses de duração. Concomitantemente, relata tontura do tipo desequilíbrio, que ocorre apenas ao movimentar a cabeça rapidamente após as crises descritas. Refere último episódio há alguns meses, com melhora após manobras de reposicionamento.
Nega sintomatologia neurovegetativa ou auditiva, cefaleia, cervicalgia ou episódios prévios de tontura ao quadro descrito acima.
Antecedentes Pessoais: HAS (em uso de Atenolol 25 mg ao dia). Menopausa aos 38 anos.
CONDUÇÃO DO CASO
nistagmo vertical superior com componente rotatório anti-horário. Latente, paroxístico, fatigável e sintomático (Vídeo 1). Diagnóstico sugestivo de canalitíase de canal semicircular posterior direito.
Indicada manobra de Epley. Paciente se queixou de tontura na terceira posição da manobra (nariz voltado para o solo), sem nistagmos.
EVOLUÇÃO
Paciente permaneceu assintomática até o retorno após 14 dias. Refeita a manobra de Dix Hallpike, que foi negativa .
Solicitados audiometria, VEMP cervical E VEMP ocular.
Os resultados dos testes podem ser observados nas figuras abaixo.
FIGURA 1: Audiometria demonstra rebaixamento dos limiares em 8000 Hz em ambas orelhas.
FIGURA 2: VEMP cervical (cVEMP) dentro dos limites da normalidade.
FIGURA 3: VEMP ocular (oVEMP) apresenta assimetria interaural da amplitude das ondas.
DISCUSSÃO
A Vertigem Posicional Paroxística Benigna (VPPB) é a síndrome mais comum entre as vertigens de origem periférica. É caracterizada por episódios recorrentes e curtos de vertigem, acompanhados de nistagmo posicional e desencadeados pela posição da cabeça em relação à gravidade. A etiologia nem sempre é identificada, mas frequentemente a VPPB está associada a um processo degenerativo das máculas do utrículo e sáculo de onde ocorre o desprendimento das otocônias. As partículas liberadas migram para os canais semicirculares. A busca da etiologia pode surpreender diagnósticos como problemas vasculares, metabólicos, traumáticcos ou até tumorais. Acredita-se que a patogênese esteja relacionada ao processo degenerativo da mácula sacular e/ou utricular atribuído a esses fatores causais.
A investigação tem início no diagnóstico diferencial entre lesões do labirinto posterior e/ou em labirinto anterior, nos quadros de tontura de origem periférica. Para tanto, a audiometria é exame de simples realização.
Na suspeita de lesão de máculas vestibulares, o Potencial Evocado Miogênico Vestibular (VEMP) tem papel esclarecedor. O VEMP é um potencial evocado a partir de respostas musculares a um estímulo de curta duração. O estímulo pode ter origem sonora, galvânica ou vibratória. Os potenciais miogênicos utilizados para diagnóstico labirintico podem ser divididos em cervicais (cVEMP) e oculares (oVEMP), de acordo com os músculos efetores e áreas estimuladas. O VEMP avalia a presença de alterações degenerativas maculares a predisposição à recorrência da doença.
O cVEMP é detectado no músculo esternocleidomastoideo e traduz a inibição do reflexo vestíbulo-cólico ipsilateral. Reflete a situação funcional do sáculo e do nervo vestibular inferior.
O oVEMP é captado no músculo oblíquo inferior e traduz a ativação do reflexo vestíbulo-ocular contralateral. Avalia a atividade do utrículo e do nervo vestibular superior.
Uma metanálise realizada no ano de 2019 avaliou a latência e amplitude das ondas p13 e n23 no cVEMP de indivíduos saudáveis e diagnosticados com VPPB. Observou-se aumento de latência das ondas p13 na orelha acometida pela VPPB, além da redução da amplitude de ambas as ondas nesses pacientes em relação ao grupo controle. Essa alteração sugere degeneração neural bilateral, achado que indica lesão secular (4). O oVEMP mostrou aumento de latência n1 e diminuição significativa de amplitude das ondas, com respostas alteradas bilateralmente em 75% dos pacientes avaliados. Resultados de aumento de latência e diminuição de amplitude das ondas sugerem disfunção e degeneração utricular. Outros estudos também mostraram ausência de respostas no cVEMP em pacientes com VPPB, indicando degeneração macular extensa (1).
Alterações degenerativas otolíticas relacionadas à idade e osteoporose podem ser responsáveis pela VPPB idiopática, com padrões de respostas que reforçam essa hipótese. O aumento da latência da orelha acometida pela VPPB (1) indica atraso na resposta das máculas e mostra um padrão condizente com hipofunção. Há relação direta entre a degeneração e o consequente desprendimento de otocônias, com posterior migração para o lúmen endolinfático dos canais semicirculares. A migração de otocônias ocorre, em sua quase totalidade, da mácula utricular, por sua estreita relação anatômica com os canais semicirculares (1), embora o processo degenerativo acometa também a mácula sacular. Portanto, são comuns as alterações no cVEMP e no oVEMP.
Em nosso caso, o cVEMP apresenta respostas preservadas bilateralmente. No oVEMP notamos diminuição de amplitude do lado direito, lado acometido pelo quadro de VPPB. O resultado corrobora a hipótese de que há degeneração utricular. Em relação ao cVEMP com respostas preservadas, entendemos que a paciente apresenta um grau de degeneração pouco extenso.
O VEMP pode ser utilizado como uma medida prática e eficaz de avaliação funcional das máculas nos distúrbios vestibulares de origem periférica, em especial a VPPB (1). Observa-se, nos pacientes com VPPB idiopática, uma resposta alterada no exame em questão, especialmente o oVEMP. O fato ratifica a hipótese de que a degeneração da mácula do utrículo e do sáculo levam ao desprendimento das otocônias e aumentam a chance de VPPB.
Os exames citados nesse texto não têm como finalidade substituir o exame clínico e as manobras para o diagnóstico da VPPB. Sua função exclusiva é acrescentar dados auxiliares, que possam explicar a ocorrências da síndrome quando não há etiologia clara da doença. Seus achados demostram que esses pacientes apresentam risco aumentado de desenvolver VPPB repetidas, secundárias à degeneração do órgão macular.
Referências
Mauricio Malavasi Ganança, Professor Titular de Otorrinolaringologia da Universidade Federal de São Paulo – Escola Paulista de Medicina (UNIFESP-EPM)
Heloisa Helena Caovilla, Professor Associado Livre Docente da Universidade Federal de São Paulo – Escola Paulista de Medicina (UNIFESP-EPM)
Zumbido e/ou perda auditiva foram relatados em 9,6% dos casos no episódio agudo da vertigem posicional paroxística benigna (VPPB)1.
Provável conexão foi encontrada entre VPPB crônica e zumbido, dor cervical, cefaleia, dor generalizada, fadiga, distúrbios visuais, disfunção cognitiva e náusea2.
A relação entre os sistemas vestibular e coclear é bem conhecida. Várias afecções que acometem um desses sistemas podem também envolver o outro, ao mesmo tempo ou posteriormente. Verificou-se que o zumbido, eventualmente associado à VPPB, era moderado ou severo, contínuo ou posicional, mais frequente na cabeça do que nos ouvidos e desaparecia após manobras de reposicionamento de otólitos de Semont e/ou Epley. O alívio imediato do zumbido seria mediado por redução na atividade autonômica, conhecida por afetar esse sintoma3.
Em 19,3% de 171 casos com VPPB e audição normal foi notado zumbido ipsilateral, intermitente e de intensidade leve, que diminuía ou desaparecia com as manobras. Foi aventada a hipótese da origem vestibular, por deslocamento de debris maculares para o ductus reuniens e o ducto coclear4. Os debris maculares, ao se moverem na direção do ducto reuniens ou ducto e saco endolinfáticos, podem desencadear zumbido ipsilateral, surdez súbita ou doença de Menière em casos coexistentes com VPPB5.
Em nossa experiência, 13 (13,0%) de 100 casos com VPPB, por canalitíase de canal semicircular posterior unilateral, relataram zumbido ipsilateral nos episódios vertiginosos posicionais, com avaliação audiológica normal. Sete (53,8%) casos relataram redução ou eliminação do zumbido: dois às manobras diagnósticas de Dix-Hallpike, Pagnini-McClure e hiperextensão cefálica, quatro logo após uma manobra de Epley seguida por duas de Semont na mesma sessão e um à reavaliação sete dias depois. Em alguns casos com contraindicações para as manobras terapêuticas, as manobras diagnósticas podem eliminar a vertigem e o nistagmo posicional durante semanas, meses ou anos; a manobra de Dix-Hallpike repetitiva é um dos recursos para o tratamento da VPPB atípica de canal semicircular posterior5.
Observamos que oito (61,5%) dos 13 casos de VPPB com zumbido referiram diversos sintomas sugestivos de enxaqueca típica, atualmente ou no passado. A possível associação da VPPB aos quadros clínicos de Migrânea e Migrânea vestibular é muito frequente6-8.
Portanto, não apenas as manobras terapêuticas de reposicionamento de otólitos como os procedimentos diagnósticos podem influir na evolução favorável do zumbido em pacientes com VPPB.
Referências
Mauricio Malavasi Ganança, Professor Titular de Otorrinolaringologia da Universidade Federal de São Paulo – Escola Paulista de Medicina (UNIFESP-EPM)
*Continuação de LIDANDO COM AS FACETAS ATÍPICAS DA VPPB, Otoneurologia.org.br, 18 /07 /2019.
CENÁRIOS DIAGNÓSTICOS
Quanto à vertigem e ao nistagmo posicional, a canalitíase de braço longo dos canais lateral ou posterior representa a forma típica da VPPB. Aproximadamente 35% dos casos de VPPB apresentam alguma atipia. Canalitíase de braço curto de canais lateral e posterior, cúpula leve de canal lateral e cúpula pesada (cupulolitíase ou não) de canais lateral e posterior são formas atípicas. As atipias da VPPB de canal lateral são mais comuns do que as do canal posterior; as atipias do canal anterior são mais raras(1-19). Muitos aspectos diagnósticos e terapêuticos das atipias da VPPB ainda não estão totalmente esclarecidos ou são controversos(15).
A figura 1 mostra características do nistagmo posicional nas formas atípicas de VPPB.
CENÁRIOS TERAPÊUTICOS
A figura 2 apresenta opções terapêuticas nas formas atípicas de VPPB de acordo com o canal semicircular acometido.
A figura 3 inclui ilustrações das manobras terapêuticas que temos empregado mais frequentemente na canalitíase de braço longo da forma típica de VPPB e em determinadas variantes atípicas como cúpula pesada (quando o substrato for a cupulolitíase), canalitíase de braço curto, canalitíase e cupulolitíase de canal anterior, considerando o acometimento dos canais posterior e lateral do labirinto direito e anterior que pode ser do labirinto direito ou esquerdo.
A cúpula leve ou cúpula pesada (excluindo a cupulolitíase como causa), em que não haveria otólitos como substrato da VPPB, não costumam responder às manobras de reposicionamento(1,8,9). O tratamento conservador para a cúpula leve ou pesada pode incluir agitação cefálica, vibração da mastoide, mudança de hábitos e estilo de vida, reabilitação vestibular e/ou fisioterapia de equilíbrio corporal, medicação antivertiginosa e profilaxia de enxaqueca se estiver associada à VPPB.
OUTROS CENÁRIOS
O eventual envolvimento dos debris no desencadeamento de zumbido ipsilateral, surdez súbita ou doença de Menière concomitantes com VPPB é ilustrado na figura 4.
Formas típicas ou atípicas de VPPB (bem como de doença de Menière, cinetose e mal de desembarque) são muito mais comuns em pacientes que têm ou tiveram enxaqueca (migrânea com ou sem aura, migrânea vestibular, equivalente tardio de migrânea), que apenas têm familiares próximos enxaquecosos ou relatam somente traços isolados sugestivos da doença(7,8,15). A migrânea também causa frequentemente tontura e/ou vertigem posicional que não correspondem à VPPB, concomitantes ou não no mesmo paciente. A associação da VPPB com tontura postural perceptual persistente também é comum.
A VPPB tem sido correlacionada com o baixo nível sérico de vitamina D(17,18). A possível influência de alterações glicêmicas e/ou insulinêmicas e de outras comorbidades precisa ser considerada(18,20 )
O diagnóstico diferencial com a vertigem posicional de origem central deve ser ponderado, especialmente nos casos resistentes a tratamento.
Para diferenciar os resultados atribuíveis à terapêutica na VPPB típica ou atípica de possível resolução espontânea avaliar após a intervenção: 1) alívio sintomático imediato; 2) evolução progressiva favorável no mesmo dia, no dia seguinte e depois de 48 horas(14).
Os diferentes aspectos diagnósticos e terapêuticos da VPPB atípica despertam cada vez mais a atenção dos otorrinolaringologistas, suscitando dúvidas e debates que exigem ampla pesquisa científica para a devida elucidação.
Referências
Mauricio Malavasi Ganança, Professor Titular de Otorrinolaringologia da Universidade Federal de São Paulo – Escola Paulista de Medicina (UNIFESP-EPM)
A vertigem posicional paroxística benigna (VPPB), a mais comum das vestibulopatias periféricas apresenta manifestações clínicas típicas 1,2 e atípicas3-10.
É notório o crescente interesse no melhor conhecimento científico das formas atípicas da VPPB7-10. Os aspectos misteriosos e intrincados das diversificadas atipias já estão sendo vislumbrados, explorados e desvendados, gerando novos reconhecimentos e resoluções.
Os critérios diagnósticos da VPPB propostos em 2015 pela Bárány Society3, recentemente revisitados pela American Academy of Otolaryngology – Head and Neck Surgery 4, pela Japan Society for Equilibrium Research em 20175 e pela Comisión de Otoneurologia de la Sociedad Española de Otorrinolaringología y Cirurgía de Cabeza y Cuello6 em 2018, inserem atenção à atipicidade da afecção.
As atipias podem ser causadas por otólitos na endolinfa (canalitíase no braço longo ou curto do ducto semicircular afetado) ou aderidos à cúpula da crista ampular (cupulolitíase) ou ainda suscitadas por alterações da densidade endolinfática ou cupular, caracterizando cúpula leve ou cúpula pesada.
Variantes atípicas são as formas da VPPB que apresentam peculiaridades diferentes das habitualmente encontradas, quanto às características ou prevalência. Se acatarmos o sentido literal e amplo da palavra, podemos visualizar a incorporação de aspectos invulgares, diferentes e particulares em parcela não desprezível do universo de pacientes com VPPB. A figura 1 engloba situações, configurações clínicas e terapêuticas que espelham manifestações atípicas da VPPB.
Em todas as suas formas típicas ou atípicas, a VPPB pode preceder, coincidir com o período da vertigem aguda episódica ou ocorrer posteriormente na fase de estabilização da doença de Menière; surgir durante ou após o episódio de vertigem aguda da neurite vestibular e em diversos outros quadros clínicos otoneurológicos ou otológicos, como deiscência de canal superior, trauma craniano ou cervical, vestibulopatias metabólicas, hormonais ou vasculares, ototoxicidade, fístula perilinfática, otite média crônica, otosclerose e iatrogenia (pós-cirurgia otológica); ser precipitada por fatores como anestesia geral e inatividade física prolongada.
A expansão gradativa da prevalência das atipias constatada nos últimos anos pode estar relacionada com o atendimento pelo otorrinolaringologista de um número progressivamente maior de pacientes com migrânea e migrânea vestibular, em que a ocorrência da VPPB e, sobretudo do seu formato atípico, é muito mais comum do que a observada em pacientes não migranosos.
Figura 1. Cenários da atipicidade da VPPB.
É importante frisar que a videonistagmografia (VNG) é um recurso vantajoso para registro e gravação em vídeo do nistagmo posicional da VPPB, auxiliando na identificação de um número maior de atipias, abarcando inclusive variantes do nistagmo posicional no acometimento dos canais lateral, posterior e anterior ou múltiplo por envolvimento de vários canais3.
Todas as variantes atípicas da VPPB devem sempre merecer diagnóstico diferencial com a vertigem posicional central, que pode ser ocasionada principalmente por alterações anatômicas, vasculares, degenerativas ou tumorais da fossa posterior. Nesse sentido, precauções devem ser tomadas primordialmente nos casos de nistagmo posicional horizontal, vertical sem componente torcional, vertical para baixo e exclusivamente torcional e, ainda, na refratariedade após duas ou três sessões sequenciais de terapia, múltipla recorrência, longa persistência ou intratabilidade.
A determinação precisa do perfil otoneurológico da variante vigente no paciente é um fator decisivo para eleger a melhor solução para cada uma das exteriorizações clínicas inusitadas ou inesperadas da VPPB.
Para completar o desenvolvimento do corrente texto sobre a multifacetada VPPB atípica, as partes II – Cenários Diagnósticos e Terapêuticos e III – Outros Cenários, serão focalizadas posteriormente de forma consecutiva.
Referências