Dr. Marcelo Henrique de Oliveira
Introdução
Considerada uma emergência otorrinolaringológica, a perda auditiva neurossensorial súbita (PANSS) requer um diagnóstico e abordagem imediatos. Caracteriza-se por um quadro de início abrupto de perda auditiva superior a 30db em pelo menos três frequências audiométricas consecutivas em um período de 72 horas.1
Embora, algumas vezes, possamos identificar os fatores etiológicos que levam a PANSS, 90% dos casos são de natureza idiopática 2. Dentre as etiologias primarias de PANSS, deve-se considerar como fator causador da patologia uma das três possibilidades a seguir: infecção viral, insuficiência vascular e distúrbios autoimunes. Como causas secundárias, pode citar as neoplasias, AVC, irradiação dentre outros.3
É comprovada a existência de uma forte associação entre uma infeção viral (por exemplo arenavírus, adenovírus) e PANSS. A explicação para tal é baseada em algumas hipóteses, como o acesso viral direto ao labirinto e nervo coclear, reativação viral no gânglio espiral e a imunorregulação por parte do hospedeiro. 4
Com o advento do SARS- COV-2 em Wuhan (China), em dezembro de 2019, o mundo viu-se diante de uma pandemia com consequências que reverberam até os dias atuais. Seus sintomas mais comuns incluíam tosse (68%), febre alta (88%) vômito (5%) e diarreia (3.7%), embora a cefaleia, mialgia, náusea e anosmia também fossem relatados.5
No âmbito da otorrinolaringologia, suas manifestações abrangem anormalidades de olfato e paladar, disfonia, dor de garganta, obstrução nasal dentre outros. Há forte associação entre os sintomas apresentados e as repercussões dos danos causados pela inflamação viral local, disfunção tubária e invasão neural direta6. Contudo, observou-se que alguns indivíduos infectados evoluíam com PANSS. Várias hipóteses que tentam esclarecer essa associação têm sido levantadas ao longo dos anos. Hoje, sabemos que o SARS-CoV-2 utiliza, como receptor de entrada na célula, a enzima conversora de angiotensina tipo 2 (ECA-2), uma molécula expressa em abundância na superfície das células do endotélio, dos rins, pulmões, cérebro, medula oblonga e lobo temporal. Além disso, sua ação seria responsável pela liberação de citocinas e culminaria em hipóxia, provocando lesões no aparelho auditivo. 7
Outro fator relevante é a coagulopatia causada pelo SARS-CoV-2, a formação de microtrombos e microhemorragias, como consequência de uma superprodução de citocinas inflamatórias. Casos de microhemorragias intralabirínticas são responsabilizados como explicação etiológica para a PANSS, na vigência de infecção pelo SARS-CoV-2.8
RELATO DE CASO
Paciente CCAP, sexo feminino, 34 anos, referiu infecção de vias aéreas superiores (IVAS) com sintomatologia exuberante em julho de 2023, posteriormente diagnóstica com COVID-19. Relata como sintomas mais proeminentes, o mal-estar generalizado, adinamia e febre aferida. Apresentou melhora gradual ao longo dos dias, porém, evoluiu com sensação de plenitude aural em ouvido direito e vertigem.
Dirigiu-se ao setor de emergência de uma unidade privada de atendimento especializado, para uma avaliação com otorrinolaringologista. Após a anamnese, exame clínico e acumetria, foi diagnosticada perda auditiva neurossensorial súbita em ouvido direito. Solicitado exame audiométrico (figura1).
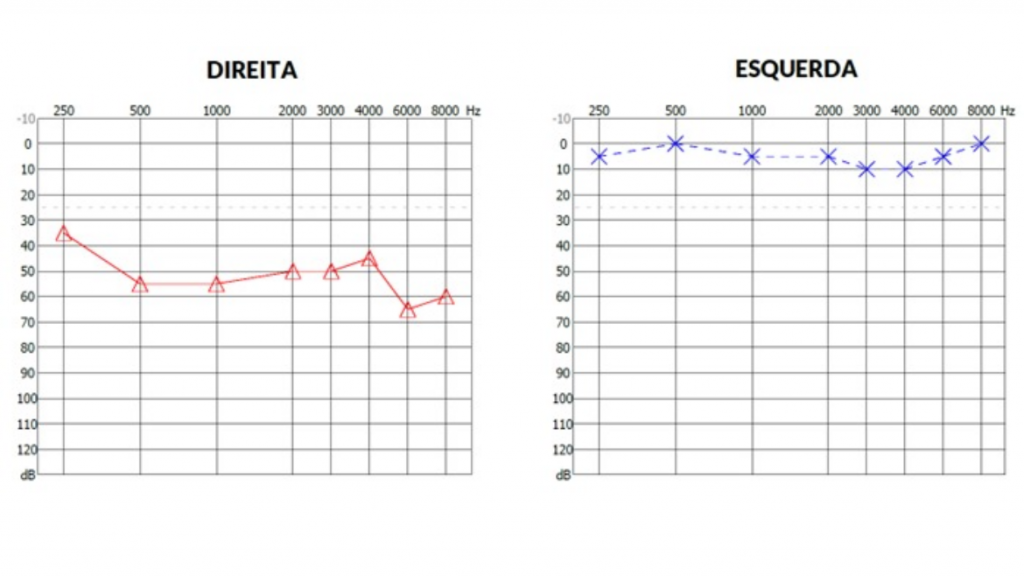
Figura 1: audiometria de entrada mostrando rebaixamento tonal moderado em orelha direita ao redor de 55 db.
O exame de Ressonância Nuclear Magnética de Crânio realizado na mesma semana não encontrou anormalidades. Foi prescrito tratamento por 10 dias com prednisolona , pentoxifilina e aciclovir. Durante o tratamento, paciente referiu melhora parcial da audição em ouvido direito. Solicitada nova audiometria após 10 dias (figura 2).
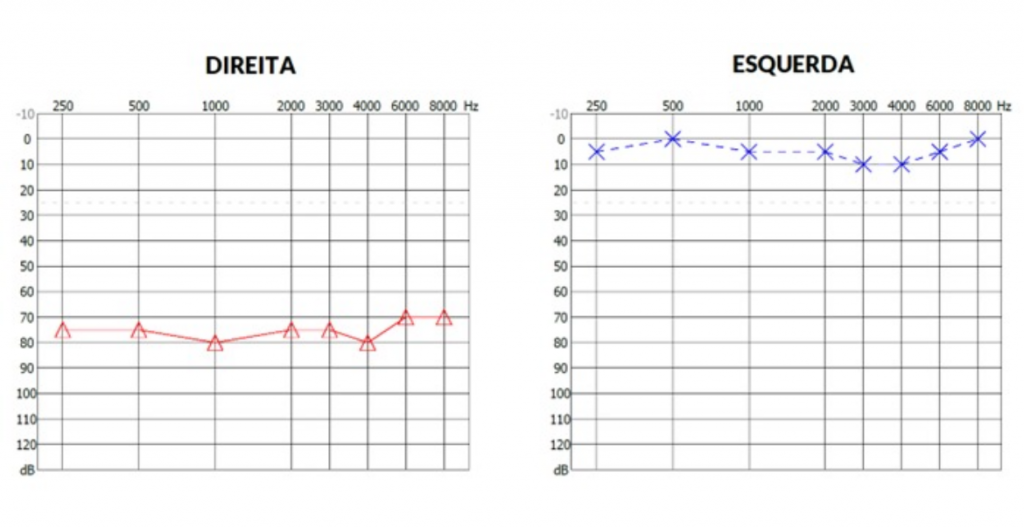
Figura 2: audiometria após os 10 dias de corticoterapia mostrando rebaixamento severo do limiar tonal em orelha direita ao redor de 75 dB.
Após dez dias da última audiometria, apresentou novo quadro de vertigem associado a sintomas neurovegetativos, de maior intensidade que o primeiro episódio. Evoluiu com piora da hipoacusia a direita, sendo então aplicada injeção intratimpânica com corticoide, sem benefício para a audição após o procedimento, vide audiometria realizada vinte dias após o procedimento (figura 3[rb1] ).
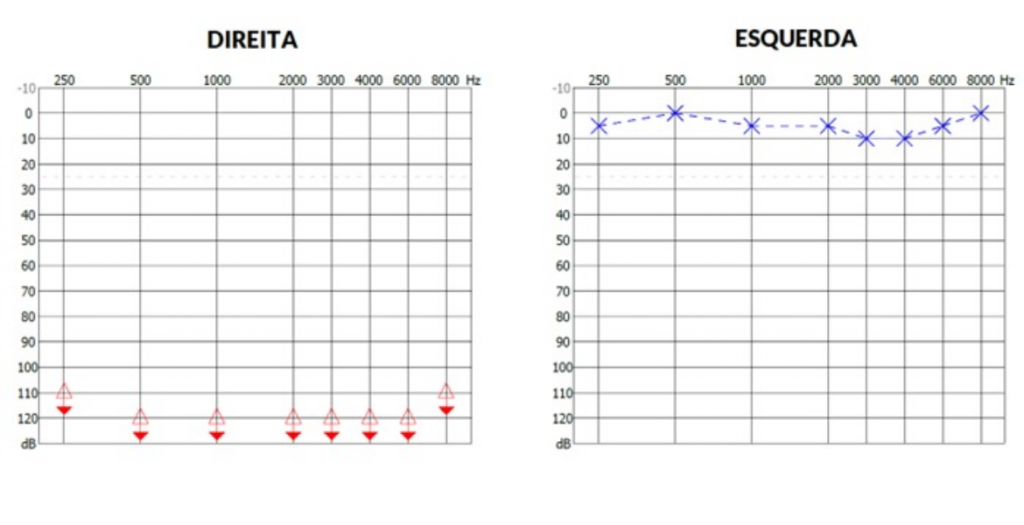
Figura 3: audiometria após 60 dias do evento agudo mostrando anacusia em orelha direita.
Após o procedimento houve melhora dos sintomas nauseosos, mas persistência de vertigem de característica mais branda. Ao exame físico foi possível observar presença de nistagmo espontâneo com componente rápido em direção a orelha esquerda e Head Impulse Test com presença de sacadas corretivas. Para melhor investigação diagnóstico, solicitou-se Video Head Impulse Test (vHIT), RNM e Eletronistagmografia com prova calórica.
A Eletronistagmografia evidenciou ausência de nistagmo espontâneo e semi-espontâneo, ausência de nistagmos posicionais e rastreio pendular tipo 1. O teste optocinético encontrava-se simétrico bilateralmente. Dix Hallpike negativo. Prova pré-calórica sem alterações com EIFO presente. Predomínio labiríntico (PL) de 77% para a esquerda (para um normal até 19%) e preponderância direcional (PD) de 2% para a direita.
Realizado vHIT e SHIMP conforme as figuras 4 e 5, respectivamente.
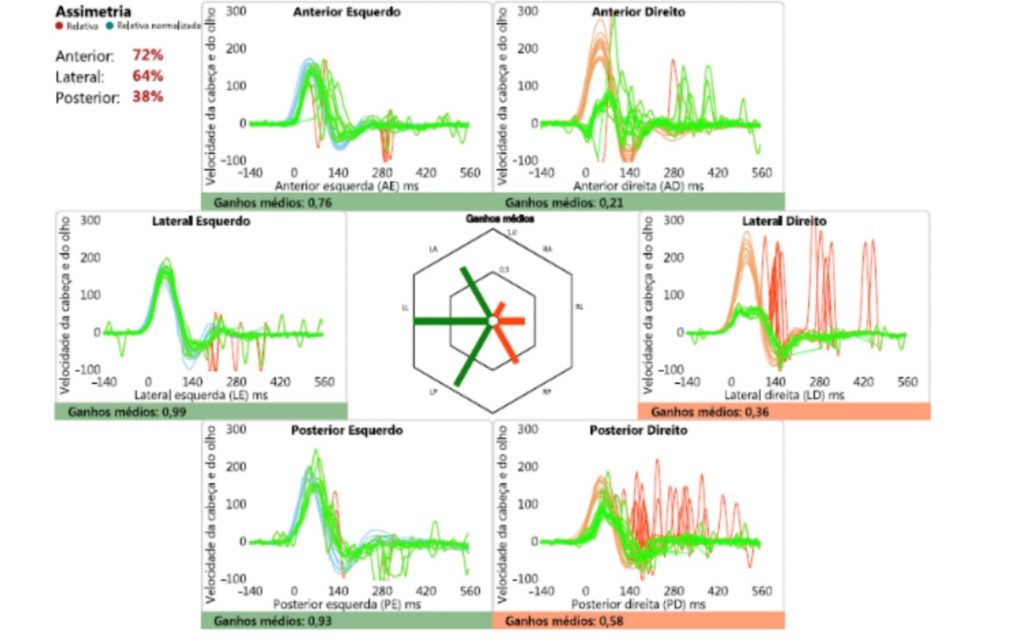
Figura 4: vHIT demonstrando baixo ganho e sacadas descobertas em todos os canais do lado direito.
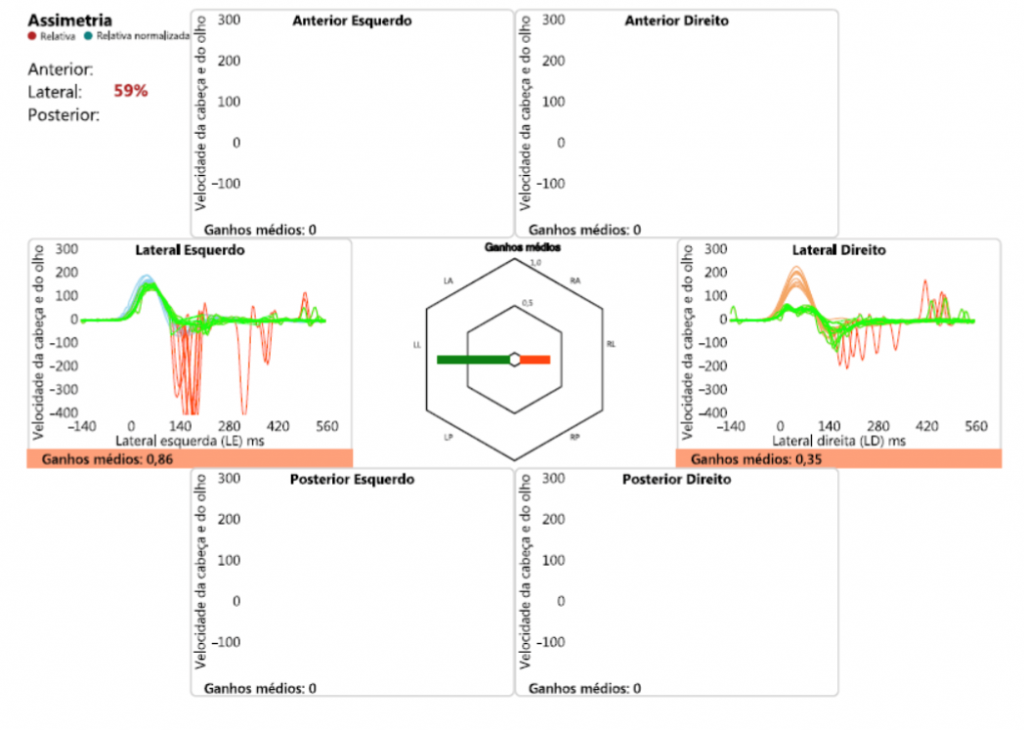
Figura 5: SHIMP demonstrando comprometimento do RVO do lado direito.
Uma nova Ressonância Magnética (RNM) de Crânio foi realizada após dois meses do evento agudo. Na nova imagem, nota-se impregnação pelo contraste paramagnético na topografia da cóclea a direita em sequências convencionais. No estudo de sequência volumétrica tardia, para estudo de hidropisia endolinfática, é observado o comprometimento da cóclea, vestíbulo direito, canais semicirculares, bem como do interior do conduto auditivo interno direito. As estruturas mantêm sinal preservado nas ponderações T2. A hipótese proposta é de processo inflamatório local e interrogada uma neurite vestibular com labirintite associada (figura 6),
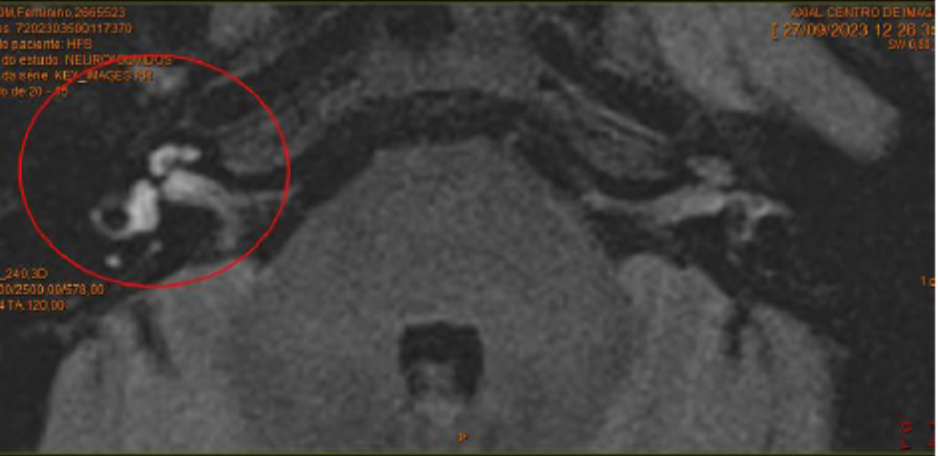
Figura 6: RM em corte axial demonstrando o realce em estruturas do labirinto e VIII par à direita.
DISCUSSÃO
A história clínica de um quadro infeccioso associado à redução da acuidade auditiva sugere a relação entre ambos. Há relatos na literatura de vírus, como citomegalovírus, influenza, paramyxovirus e coronavírus, que atuam como agentes etiológicos na surdez súbita. Neste caso, diante dos sintomas gripais e diagnóstico de COVID-19, o coronavírus pode ser suspeitado como agente responsável pela redução da audição.
O coronavírus circula sistemicamente no hospedeiro e pode afetar diversos órgãos-alvos; dentre eles a cóclea, labirinto posterior e o VIII par craniano. Esse processo infeccioso pode ser atribuído à replicação do vírus no interior das estruturas labirínticas, com consequentes danos irreversíveis ao seu funcionamento. Supõe-se que uma cascata inflamatória exacerbada quebre a barreira hemato-labiríntica, promove a contaminação do SARS-COV-2 e o surgimento de manifestações virais intralabirínticas. A RNM é o exame de imagem de escolha para avaliação da estrutura cócleo-vestibular. A inflamação da cóclea e do vestíbulo pode ser detectada pelo aumento da intensidade de sinal em T2. Quando o VIII par é afetado, haverá, ainda, aumento de sinal em T2. Nas imagens de cortes axiais da RNM desta paciente, é possível observar o aumento de intensidade de sinal em T2 da cóclea, do vestíbulo e do VIII par em sua porção mais distal. As imagens corroboram com a hipótese de labirintite acompanhada de neurite vestibular de etiologia infecciosa. É interessante notar que, a primeira ressonância, realizada na semana da surdez não apresentou alterações. No entanto, após 60 dias, a imagem de comprometimento do órgão periférico é evidente. Essas alterações surgiram simultaneamente à piora do quadro auditivo. Essas observações nos levam a inferir que a lesão pelo SARS-COV-2 foi insidiosa e progressiva.
A relação entre perda auditiva e COVID-19 é relatada em literatura, mas poucos artigos trazem exames de imagem como o descrito acima. Há relatos de infecção por COVID-19, perda auditiva e imagem normal; ou identificação de labirintite infecciosa sem neurite; ou ainda, achados inequívocos de labirintite ossificante. Até o presente momento, este parece ser o primeiro caso que relacione COVID-19 e neurite vestibular com labirintite. Apesar da ausência de exames de RNM com este mesmo padrão, não é possível excluir a possibilidade do coronavírus lesar tanto o sistema cócleo-vestibular como o VIII par.
Além da lesão direta, há outras maneiras do coronavírus lesar o sistema auditivo e vestibular, tais como tromboembolismo e a interação do complexo antígeno-anticorpo. É sabido que COVID-19 gera a formação de trombose e êmbolos, detectados pelo aumento de D-dímero no sangue. Em um contexto de complicação tromboembólica, haverá redução da perfusão da cóclea e do vestíbulo com consequente acidose local, insuficiência energética e morte celular. Outra possibilidade etiológica é a presença de complexos antígeno-anticorpo provocarem inflamação local, ativação da cascata imune e dano celular irreversíveis. As possibilidades fisiopatológicas são variadas e não é possível descartar esses mecanismos como possíveis causas da perda da função auditiva e vestibular neste caso.
Pela história relatada e pelos exames de imagem, é possível afastar etiologias como trauma acústico, trauma cranioencefálico, concussão labiríntica, Doença de Ménière e otoesclerose.
O exame clínico é fundamental para avaliar o status funcional do sistema vestibular, a despeito das imagens observadas. Diante de um paciente com vertigem e achados ao exame físico como nistagmo espontâneo e sacadas corretivas no Head Impulse Test, é importante utilizar a propedêutica armada para avaliar a função vestibular. Neste caso, foi solicitada a oculografia com prova calórica e vídeo Head Impulse Test.
A prova calórica avalia a função labiríntica por meio da irrigação do canal semicircular lateral e fornece informações sobre cada labirinto isoladamente. A irrigação calórica estimula o labirinto em baixas frequências (0,001Hz a 0,01Hz). Neste caso observamos predomínio labiríntico de 77% para o lado esquerdo em decorrência da redução da função labiríntica do lado direito. Portanto, a prova calórica confirma os achados clínicos e de anamnese, e justificam a presença de nistagmo espontâneo para esquerda.
Por outro lado, o vHIT compreende uma avaliação simultânea de ambos os labirintos, em frequência que varia de 1-10Hz. Neste caso, há redução do ganho do RVO nos canais semicirculares anterior, lateral e posterior do lado direito, acompanhada de sacadas descobertas do lado afetado. O exame físico identifica a presença de sacadas corretivas à realização do Head Impulse Test clínico. Sendo assim, o vHIT também corrobora com o exame físico. Some-se à essa descrição, o resultado do Supression Head Impulse Test (SHIMP), em que é observada a ausência de sacadas corretivas do lado direito, sugerindo a redução do ganho do RVO e a presença dos “olhos de boneca”.
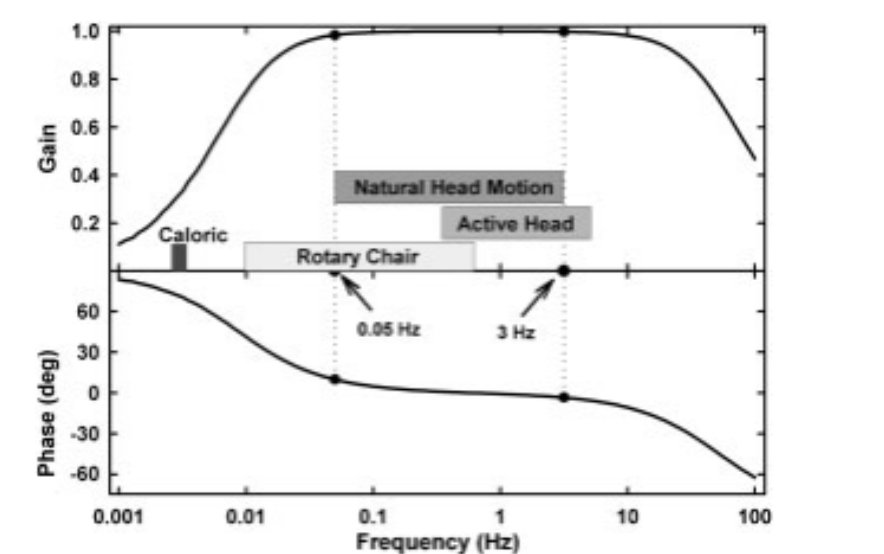
Figura 7: Gráfico demonstrando as diversas frequências de estimulação dos testes vestibulares.
Para finalizar, o início da corticoterapia tem se demonstrado eficaz quanto mais cedo é iniciada. Os glicocorticoides foram os medicamentos terapêuticos mais utilizados para PANS relacionada à COVID-19 em uma metanálise de Meng et al. Os autores propõem sua administração por via oral, intravenosa ou e/ou por via intratimpânica. Uma outra opção seria a oxigenoterapia hiperbárica. Neste caso, foi utilizada a prednisolona, pentoxifilina e aciclovir 400mg. É um protocolo padrão, que pretende reduzir o processo inflamatório, melhorar o fluxo sanguíneo terminal, além de terapia antiviral.
CONCLUSÃO
Ao longo desses três anos de pandemia, muito se descobriu a respeito do SARS-COV-2 e suas repercussões otorrinolaringológicas. Atualmente sua causalidade com a surdez súbita já está comprovada. A surdez súbita requer diagnóstico preciso e intervenção precoce pois, a partir daí, iniciamos uma corrida contra o tempo para tentar restabelecer da melhor forma a integridade do sistema auditivo do paciente. Infelizmente, nem sempre é possível reverter o processo.
Bibliografia
1 – Tripathi P, Deshmukh P. Sudden Sensorineural Hearing Loss: A Review. Cureus. 2022 Sep 22;14(9):e29458. doi: 10.7759/cureus.29458. PMID: 36299969; PMCID: PMC9587755.
2 – Prince ADP, Stucken EZ. Sudden Sensorineural Hearing Loss: A Diagnostic and Therapeutic Emergency. J Am Board Fam Med. 2021 Jan-Feb;34(1):216-223. doi: 10.3122/jabfm.2021.01.200199. PMID: 33452100.
3- Young YH. Contemporary review of the causes and differential diagnosis of sudden sensorineural hearing loss. Int J Audiol. 2020 Apr;59(4):243-253. doi: 10.1080/14992027.2019.1689432. Epub 2019 Nov 12. PMID: 31714154.
4 – Meng X, Wang J, Sun J, Zhu K. COVID-19 and Sudden Sensorineural Hearing Loss: A Systematic Review. Front Neurol. 2022 Apr 28;13:883749. doi: 10.3389/fneur.2022.883749. Erratum in: Front Neurol. 2023 May 09;14:1208650. PMID: 35572936; PMCID: PMC9096262.
5 Pradhan M, Shah K, Alexander A, Ajazuddin, Minz S, Singh MR, Singh D, Yadav K, Chauhan NS. COVID-19: clinical presentation and detection methods. J Immunoassay Immunochem. 2022 Jan 2;43(1):1951291. doi: 10.1080/15321819.2021.1951291. Epub 2021 Aug 6. PMID: 34355645.
6-Yaseen NK, Al-Ani RM, Ali Rashid R. COVID-19-related sudden sensorineural hearing loss. Qatar Med J. 2021 Oct 25;2021(3):58. doi: 10.5339/qmj.2021.58. PMID: 34745911; PMCID: PMC8555677.
7 – Saniasiaya J. Hearing Loss in SARS-CoV-2: What Do We Know? Ear Nose Throat J. 2021 Apr;100(2_suppl):152S-154S. doi: 10.1177/0145561320946902. Epub 2020 Aug 5. PMID: 32755405; PMCID: PMC7412079.
8 – Chern A, Famuyide AO, Moonis G, Lalwani AK. SUDDEN SENSORINEURAL HEARING LOSS AND COVID-19: AN EVOLVING DISCUSSION. Otol Neurotol. 2021 Aug 1;42(7):e968-e969. doi: 10.1097/MAO.0000000000003233. PMID: 34260516.
9 – Gerstacker K, Speck I, Riemann S, Aschendorff A, Knopf A, Arndt S. Deafness after COVID-19? HNO. 2021 Aug;69(Suppl 2):92-95. doi: 10.1007/s00106-021-01041-0. Epub 2021 May 21. PMID: 34019138; PMCID: PMC8138955.
10 – Bento RF, Campos TV. Hearing Loss, Tinnitus, and Dizziness and their Relation with Covid-19: what is the Current Evidence? Int Arch Otorhinolaryngol. 2022 Jan 25;26(1):e001-e002. doi: 10.1055/s-0042-1742353. PMID: 35096151; PMCID: PMC8789497.
11 – Korres G, Kitsos DK, Kaski D, Tsogka A, Giannopoulos S, Giannopapas V, Sideris G, Tyrellis G, Voumvourakis K. The Prevalence of Dizziness and Vertigo in COVID-19 Patients: A Systematic Review. Brain Sci. 2022 Jul 20;12(7):948. doi: 10.3390/brainsci12070948. PMID: 35884754; PMCID: PMC9313303.
12 – Perret M, Bernard A, Rahmani A, Manckoundia P, Putot A. Acute Labyrinthitis Revealing COVID-19. Diagnostics (Basel). 2021 Mar 9;11(3):482. doi: 10.3390/diagnostics11030482. PMID: 33803267; PMCID: PMC8002116.
13 – Barin K. Current Perspectives in Vestibular Assessment; Guest Editors, Owen D. Murnane and Faith W. Akin. Semin Hear 2009;30:253–266. Copyright # 2009 by Thieme Medical Publishers, Inc., 333 Seventh Avenue, New York, NY 10001, USA
.
[rb1]Descreva aqui a dose, forma e tipo de aplicação, número e possíveis problemas da IT